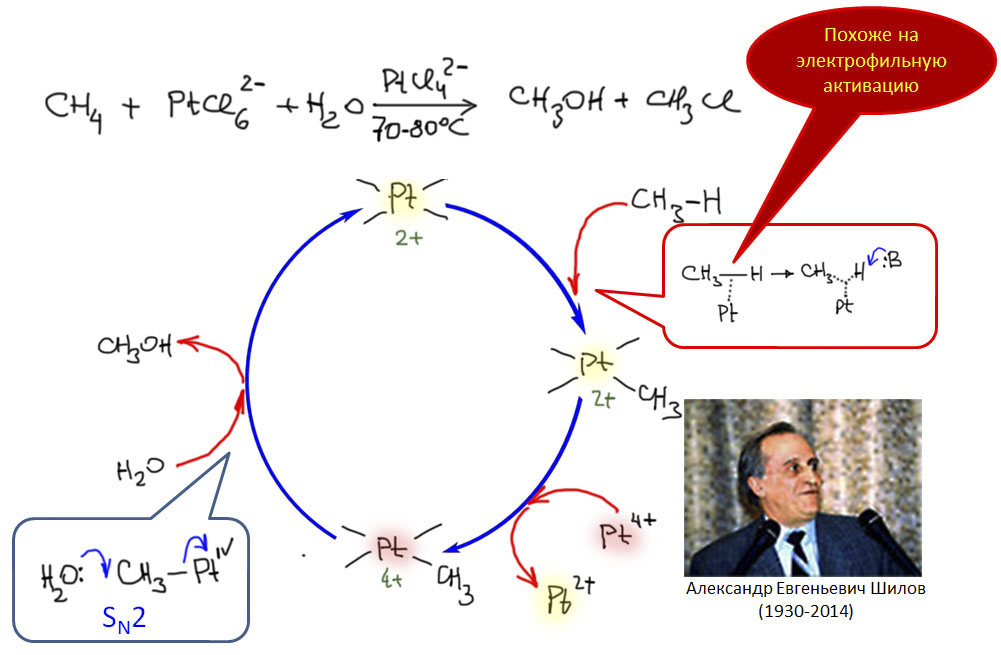
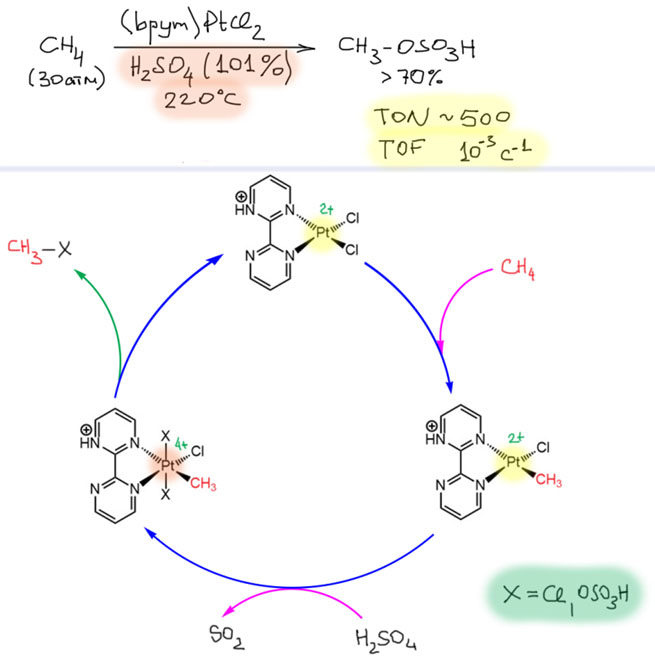
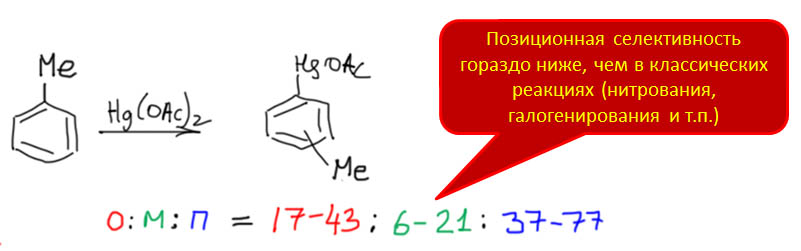
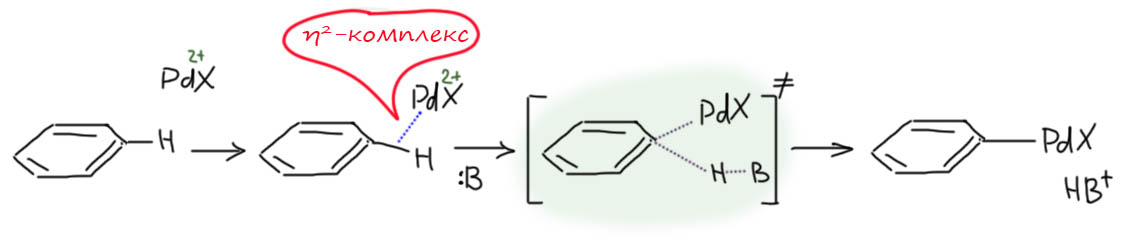
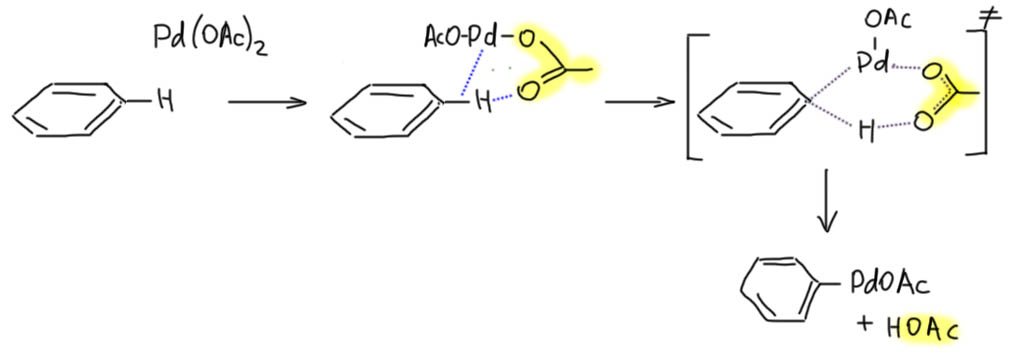
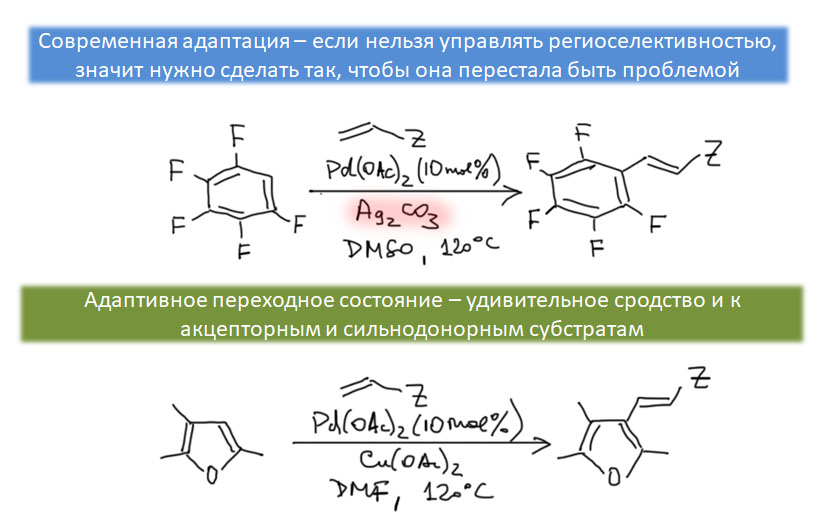
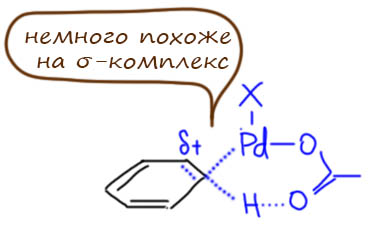
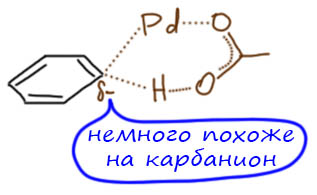
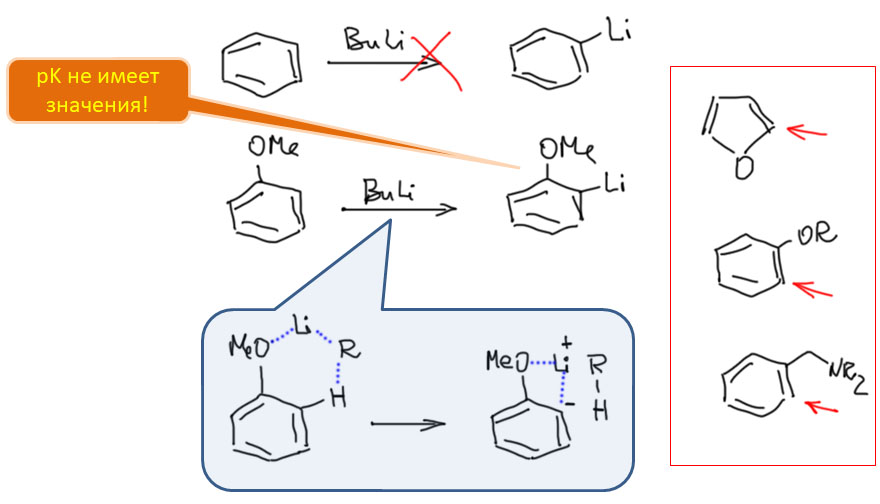
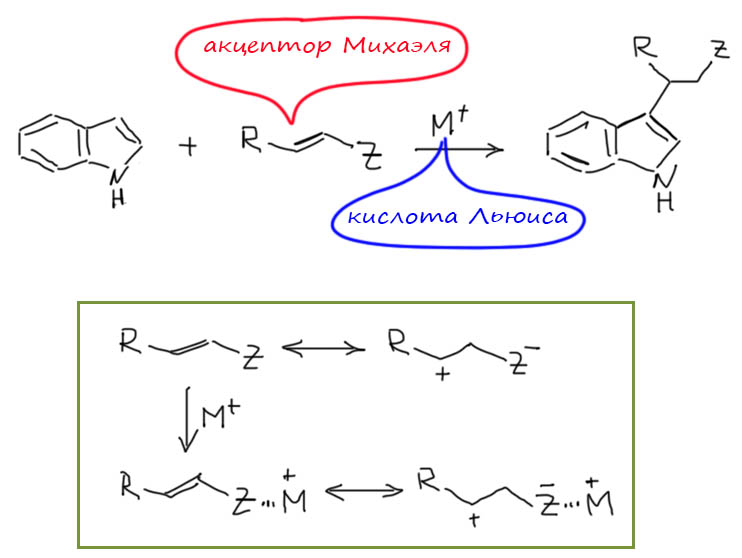
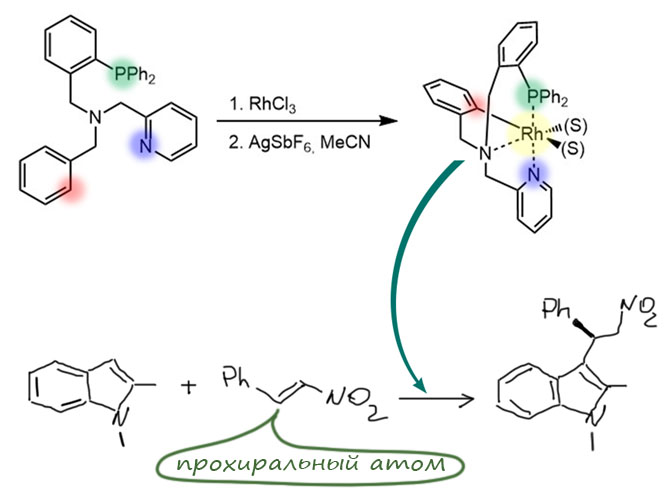
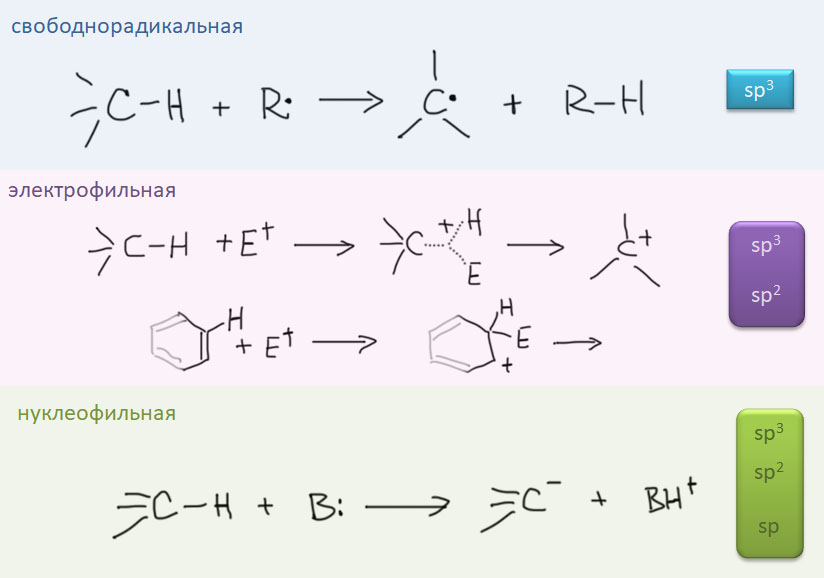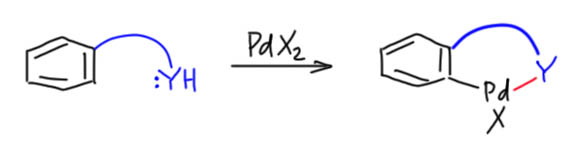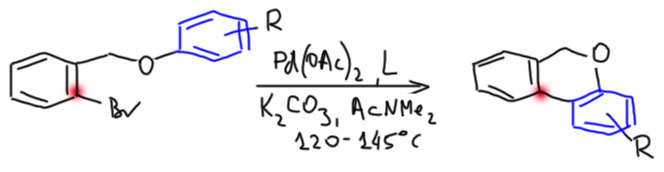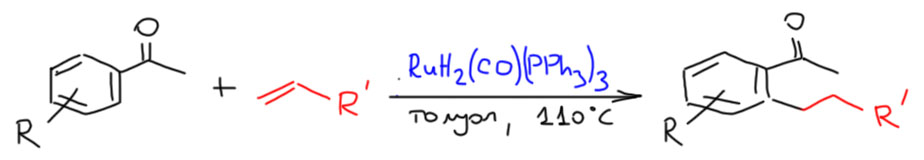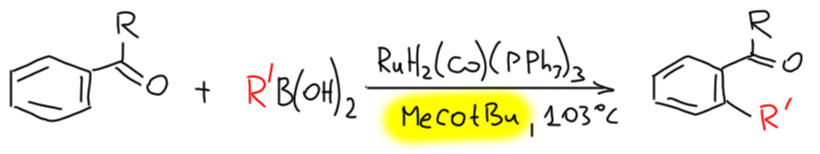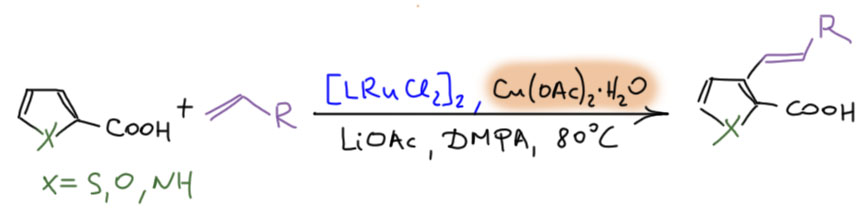CH-активация
Реакции органических соединений чаще всего происходят на определенных реакционных центрах, атомах, несущих уходящие группы, включенных в кратные связи и т.п. Но больше всего в органических соединениях атомов водорода, связанных с атомами углерода. Это настолько банальная и вездесущая часть структур органических соединений, что мы обычно вообще их не замечаем, никак не обозначаем их в структурных формулах, – просто и совершенно инстинктивно мысленно добавляем атомы водорода для соблюдения правильных валентностей.
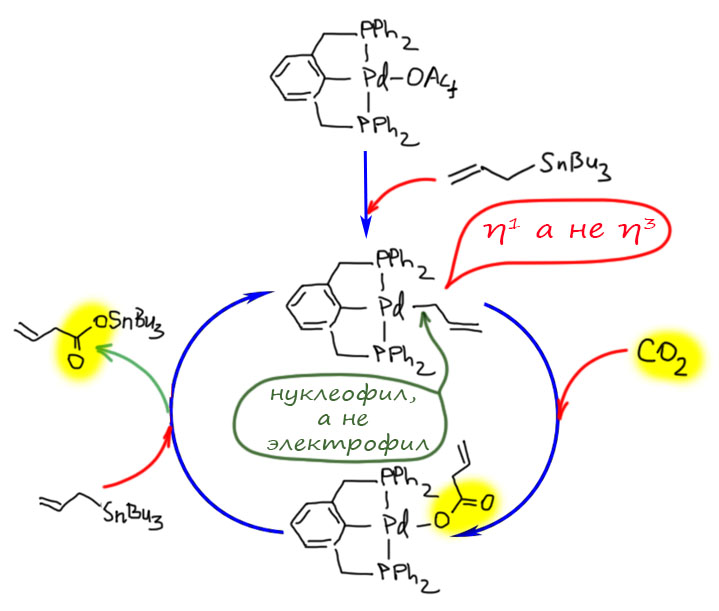
Тем не менее, именно атомы водорода на углеродах – самые лакомые кусочки органической структуры для органиков, разрабатывающих новые методы синтеза. Если удается целенаправленно и более-менее селективно заменить атом водорода на какую-нибудь группу или фрагмент, радости не бывает пределов, и самые гламурные научные журналы с радостью распахивают свои страницы для таких сообщений и статей. Почему? Строго говоря, потому, что это, во-первых, очень модно, и всё тут, а во-вторых, все знают, что это очень модно. Это главное. Научная жизнь в целом устроена точно так же, как и жизнь мира моды и шоу-бизнеса. Объяснить, почему что-то сейчас в тренде, на обложках, в речах хедлайнеров престижных конференций, а что-то украсило собой задворки жизни, практически невозможно. Мы вот только в предыдущей лекции потешались над другой гламурной темой – реакциями углекислого газа в контексте проблем с глобальным потеплением.
Но наука, безусловно, всегда старается для любого тренда придумать рациональное обоснование. В случае с атомами водорода в ход идет, в первую очередь, спасительный принцип экономии атомов. По крайней мере, с точки зрения исходных веществ и продуктов замена атомов водорода на что-то важное и полезное более всего удовлетворяет этому принципу из всех реакций замещения (реакции присоединения в любом случае вне конкуренции) – так как замещается, уходит в помойку, самый легкий из всех известных атомов, атом водорода. В этом месте обязательно нужно сделать вид, что мы не знаем, что атомы водорода сами по себе на помойку не отправляются, а непременно прихватывают еще что-нибудь – кислотный остаток, основание, акцептор атома водорода, из того, что было в реакционной смеси помимо исходного органического субстрата, и масса этого довеска будет в десятки, сотни, а то и тысячи раз превосходить массу атома водорода. Но умение деликатно делать вид, что мы не замечаем что-то такое, что замечать в данном контексте не положено – важнейший признак образованного, культурного человека. Так же и в мире моды – мы же не спрашиваем, отчего вон та модель надела на голову ведро. Если пришли на модный показ, подразумевается, что знаете, отчего можно надеть на голову ведро. А если не знаете и позволяете себе мерзко хихикать – прочь с модного показа, невежда!
Но если еще немного подумать, то придется признать, что доля правды в представлении об “атомной экономичности” методов, связанных с CH-активацией, все же есть. Если в начале всех синтетических цепочек стоят самые простые исходные, то для того чтобы ввести в молекулы хорошие уходящие группы или другие реакционные центры приходится использовать всякие вспомогательные реакции (галогенирование, нуклеофильное замещение и т.п.), часто с введением и снятием защитных групп, и цена превращения сильно возрастает, а количество отходов увеличивается. И если прикинуть всё, что пошло в помойку в метода, использующем CH-активацию, и в методе, использующем другие уходящие группы, то часто окажется, что CH-активация действительно экономнее, и даёт меньше отходов, даже если скрупулёзно посчитать всё. когда и правда проще и экономичнее придумать метод прямой модификации исходных по CH-связям. Реальность всегда сложнее принципов и идей, поэтому примем простую мысль, что запас карман не тянет, и лишние методы никогда не помешают. В лабораторном синтезе, да и в тонком органическом синтезе ценных соединений возможность получить продукт всегда важнее пути, которым этот синтез осуществляется.
Итак, мы хотим использовать в реакциях в качестве реакционных центров самые обычные CH-связи. Подразумевается, что обычно они недоступны или труднодоступны для реакций. Дело здесь часто бывает вовсе не в низкой реакционной способности таких связей, а скорее в том, что в органических молекулах полно разных связей этого типа, и задача целенаправленно выбрать только какие-то конкретные может на первый взгляд показаться вообще нерешаемой. Но она решается, и весьма типичным для органической химии способом. Нужно найти побольше методов, позволяющих воздействовать на связи нужного типа. У каждого из таких методов будут свои требования к структуре, электронным эффектам, влиянию соседних групп, стерическим факторам. Если мы располагаем большим набором методов, то в том случае, когда нам понадобится реально добраться до какого-то конкретного атома водорода в конкретной молекуле, есть надежда, что минимум один из коллекции методов подойдет. И тогда мы прославим подходящих богов и вождей, и скажем, что именно так и было задумано.
.
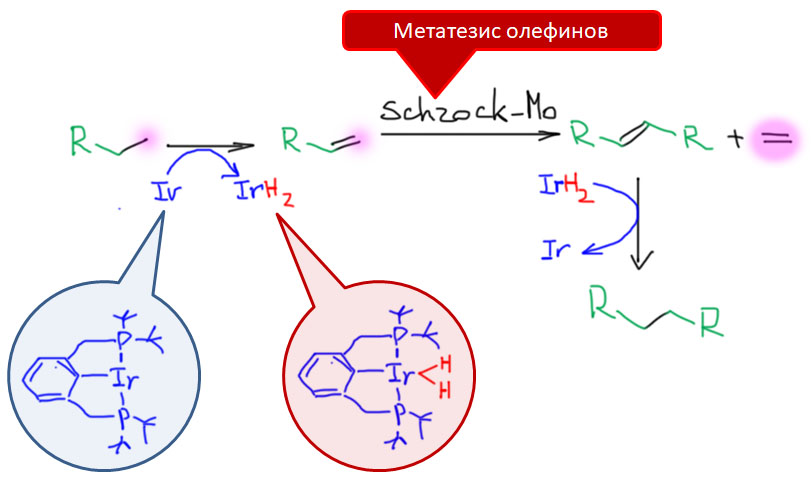
Самая сложная задача – активация алифатических CH-связей, особенно в простых алканах. Для лабораторного и тонкого органического синтеза эта задача малоактуальна, но для крупнотоннажной промышленной химии алканы – наиболее подходящее сырье, и прямая переработка алканов в ценные полупродукты – задача чрезвычайно важная просто по экономическим соображениям. На исследования возможных путей селективной активации алканов тратились и тратятся колоссальные средства. Успехов пока не очень много. Может быть, эта проблема вообще не имеет решений? Может быть, но все же некоторую надежду дает и то, что с этой задачей довольно легко справляются живые организмы, в том числе и с помощью металлокомплексных ферментных систем, и то, что за долгие годы исследований было открыто несколько перспективных процессов, показывающих, что принципиальная возможность использования алканов в крупном синтезе есть. Безусловно нельзя забывать про гетерогенный газофазный катализ – дегидрирование алканов в алкены давно уже является источником олефинов для промышленности, хотя самые востребованные олефины – этилен и пропилен – в основном получают некаталитическим паровым крекингом алканов – свободнорадикальной реакцией при высокой температуре. Но мы здесь обсуждаем гомогенные процессы в жидкой фазе. Принципиальную разницу между гетерогенным катализом и гомогенным (в том числе и гетерогенизованным гомогенным) катализом мы уже обсуждали.
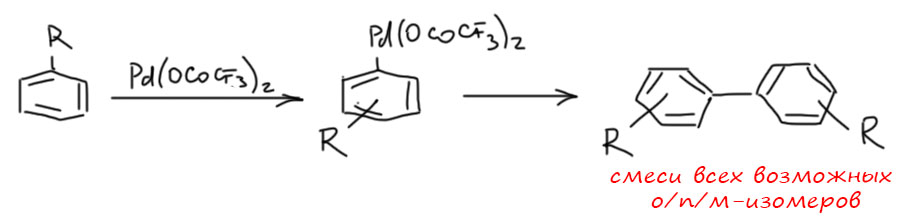
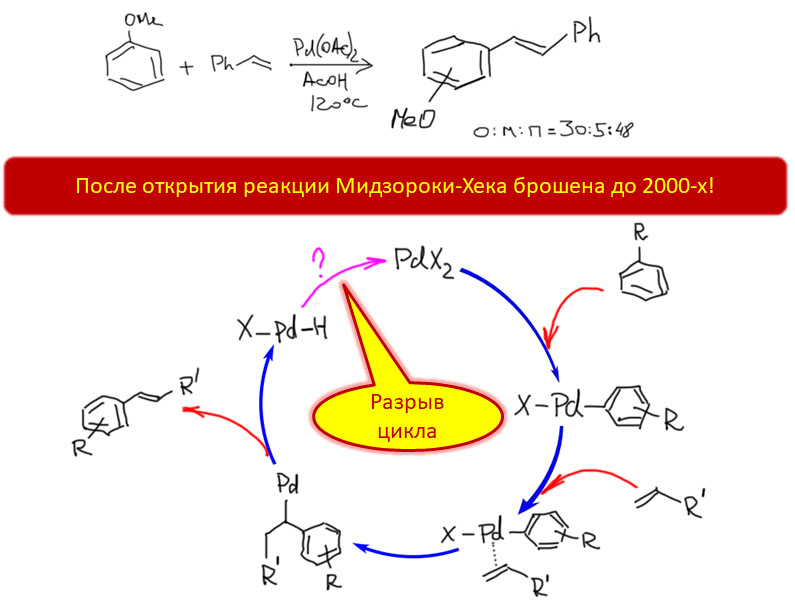
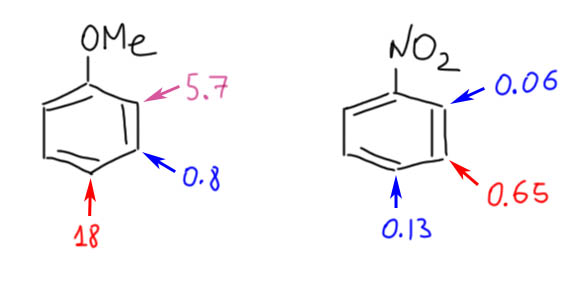
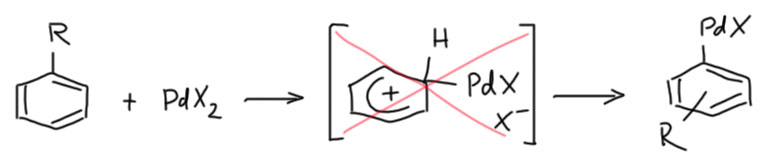
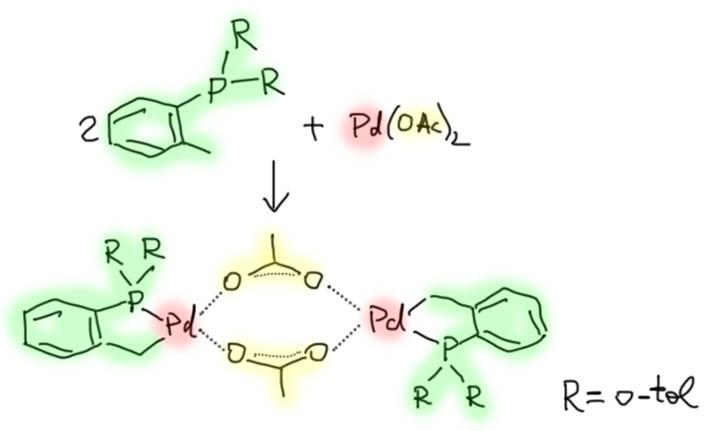
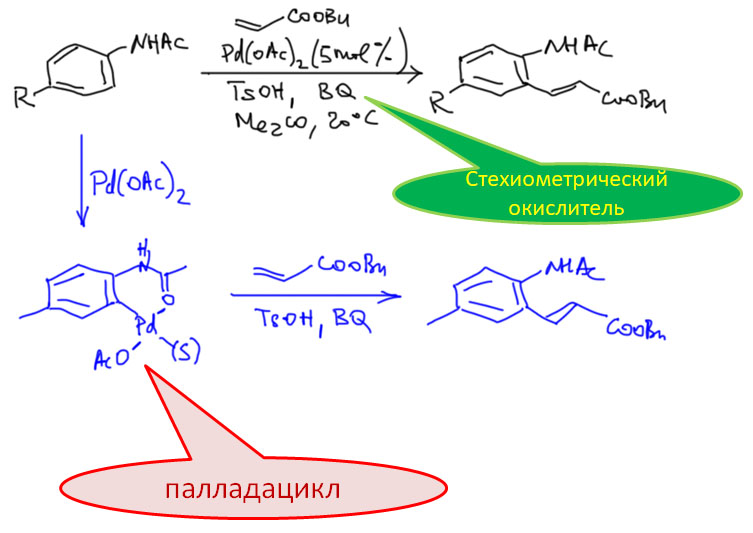
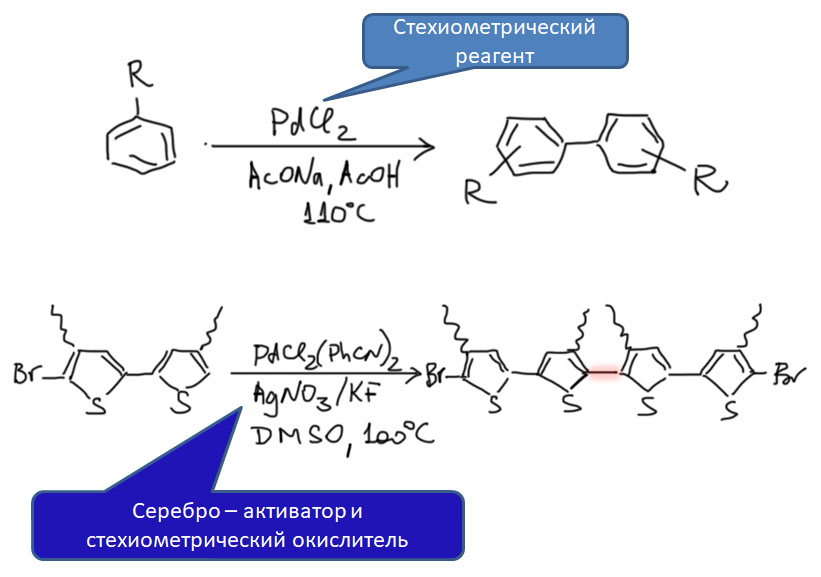
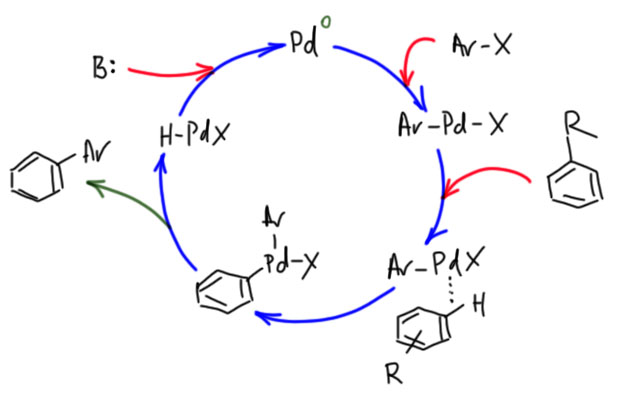
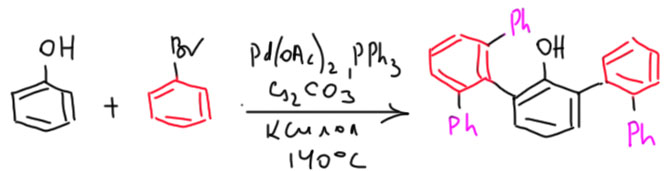
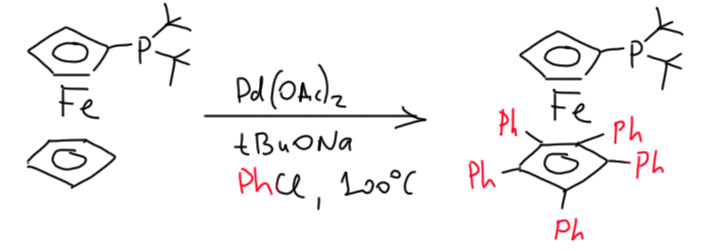
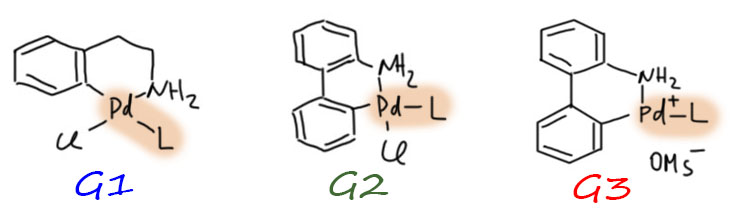
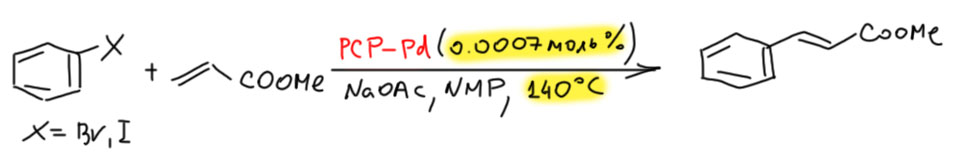
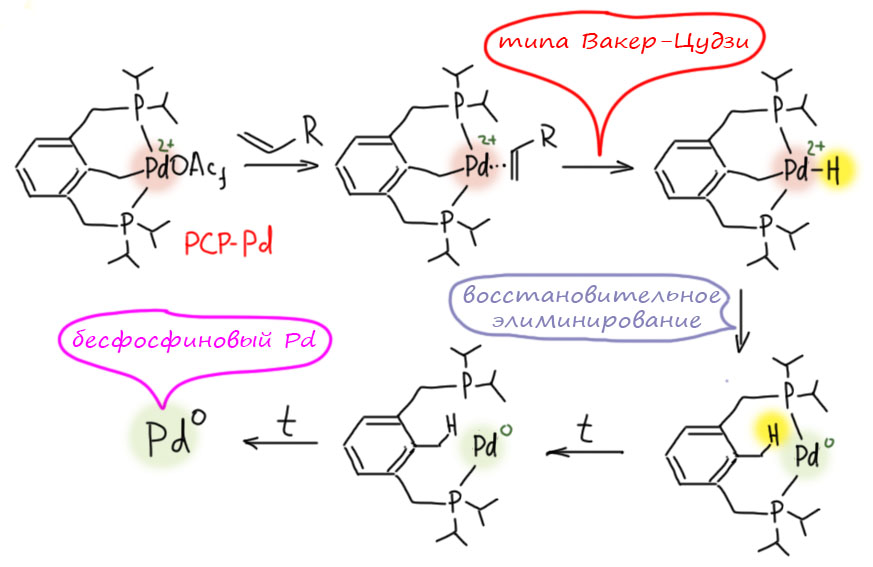
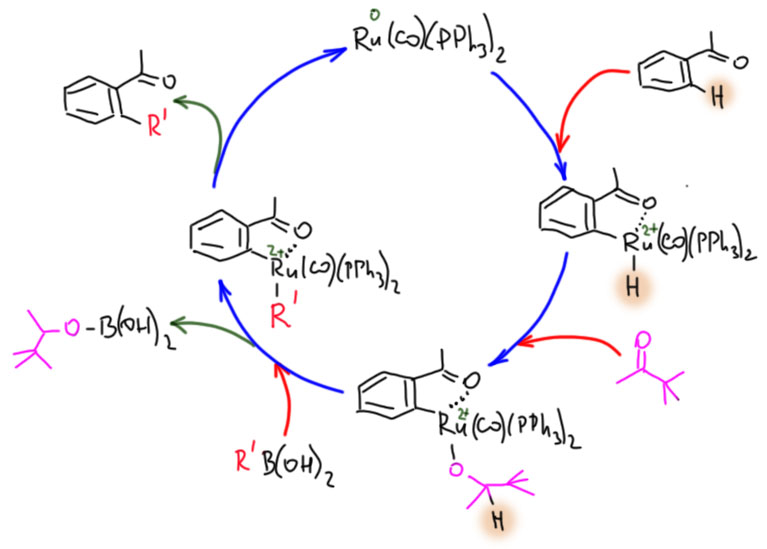
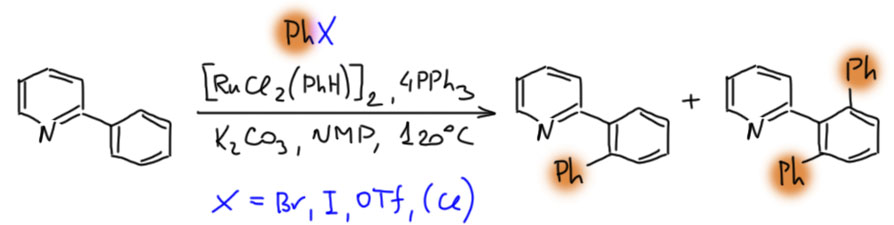
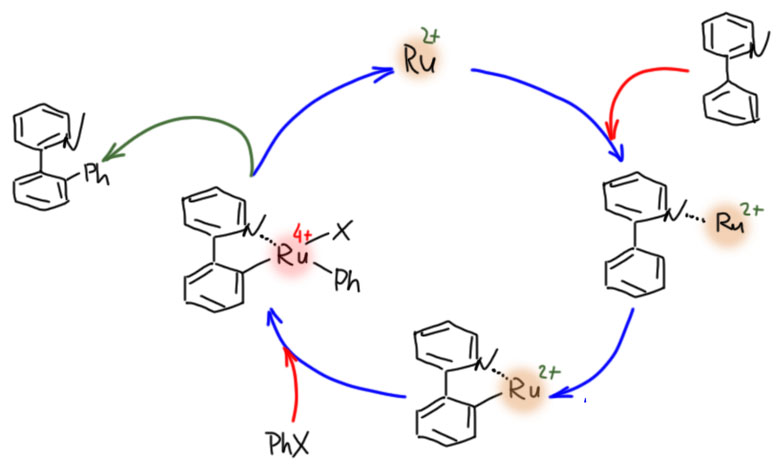
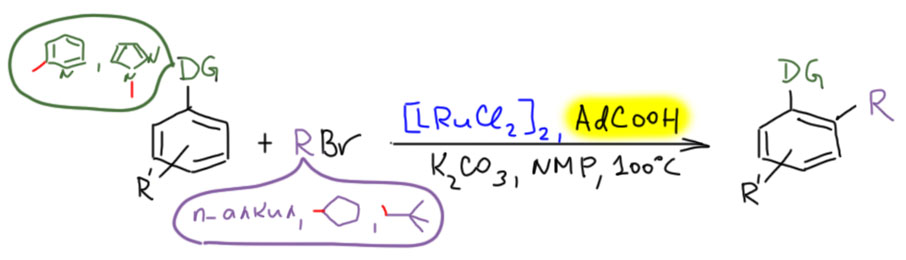
Гораздо больших практически значимых успехов удалось достичь в активации CH-связей в ароматических соединениях. Эта область с середины нулевых годов и до сих пор переживает бурный рост. Разработаны многочисленные протоколы кросс- и гомо-сочетания ароматических соединений, аналоги реакции Мидзороки-Хека, карбонилирования и множество других полезных реакций. Разработанные методы уже широко применяются в органическом синтезе. Здесь мы встречаемся с такой важной вещью как палладациклы, которые интересны не только как промежуточные соединения в направленных реакциях, но и сами по себе.
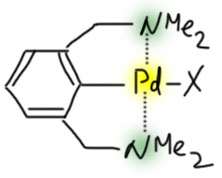
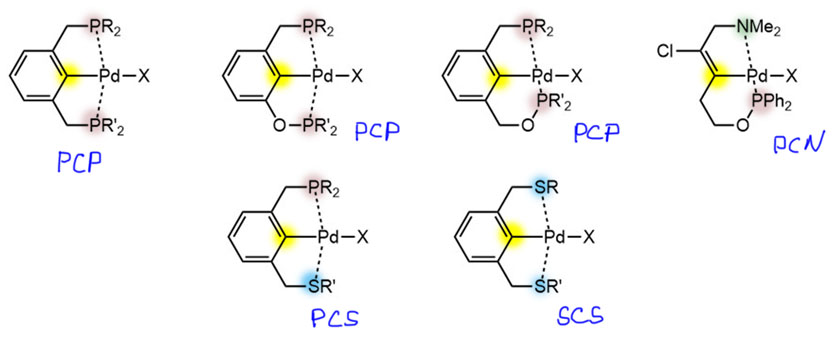
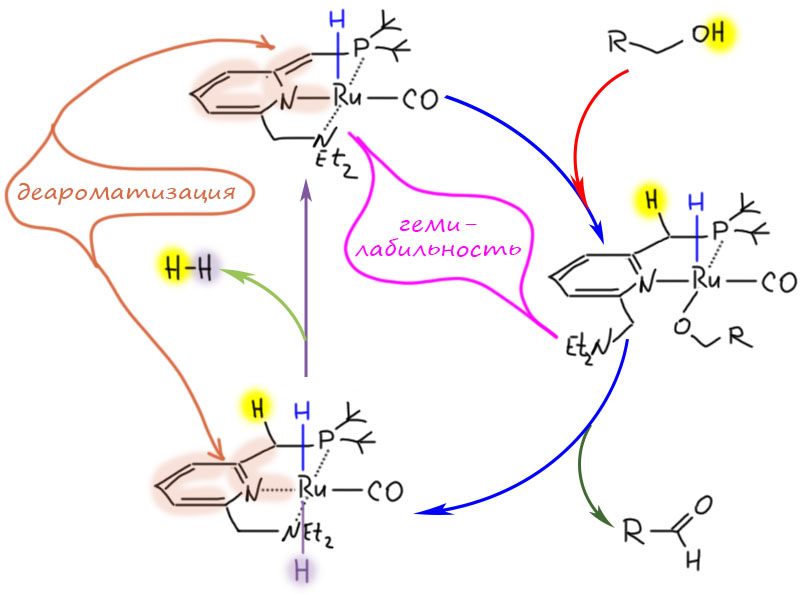
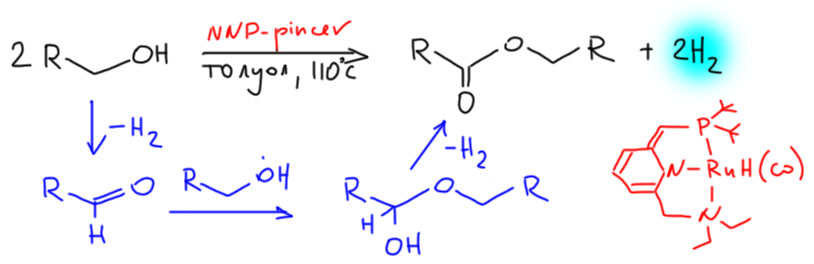
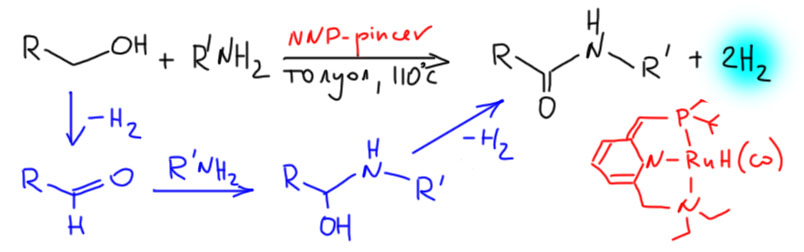
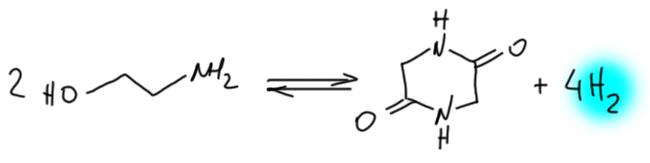
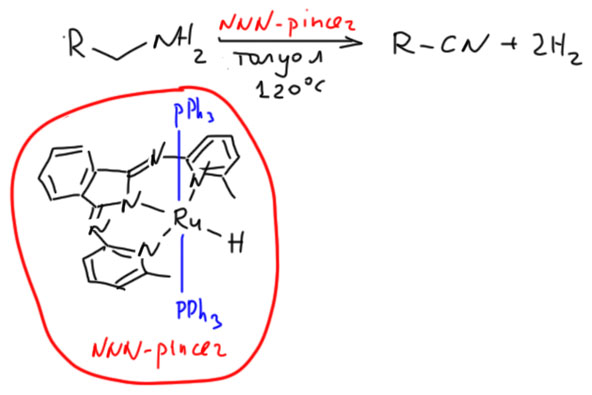
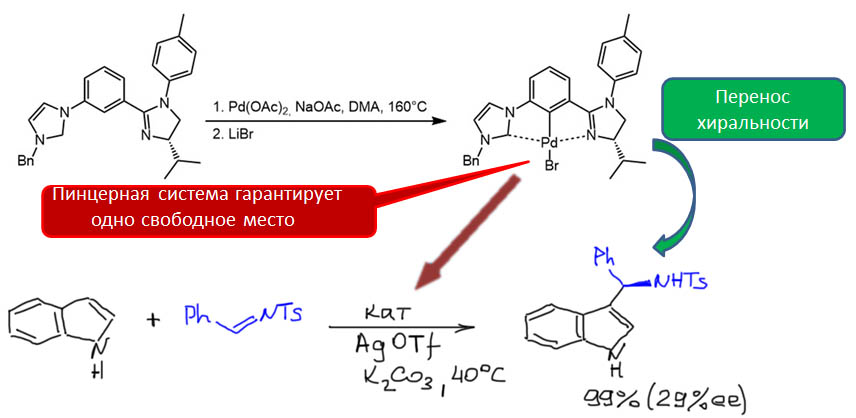
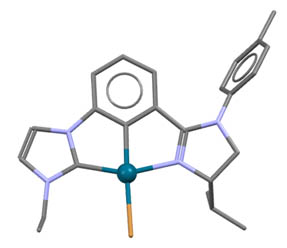
Пинцерные металлациклы.
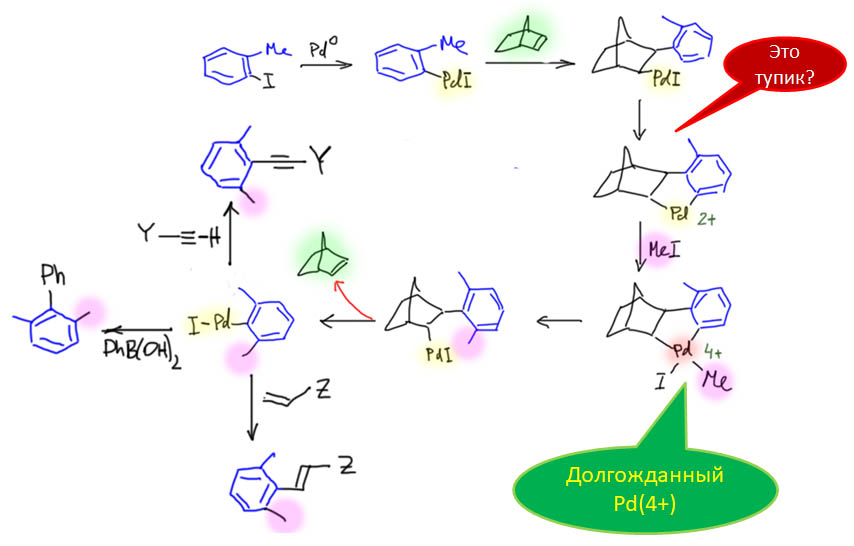
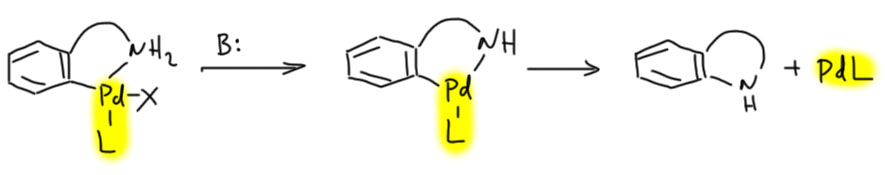
Не менее интересны и такие представители палладациклов, и даже шире, металлациклов, в которых не одна, а сразу две направляющие группы. Такие соединения называются пинцерными металлациклами, и хотя и не сразу, но в последние лет 15 эти соединения получили большую известность, так как с ними связаны совершенно необычные каталитические и стехиометрические реакции в синтезе. Жесткая структура пинцерных металлациклов не дает им участвовать в реакциях кросс-сочетания, Мидзороки-Хека и т.п. без разрушения, но может быть очень полезной в других реакциях, где остающихся координационных возможностей достаточно, а жесткий контроль координационной сферы ограничивает число возможных путей превращения. За последние 15 лет обнаружено множество реакций, критически зависящих именно от пинцерной структуры катализаторов.
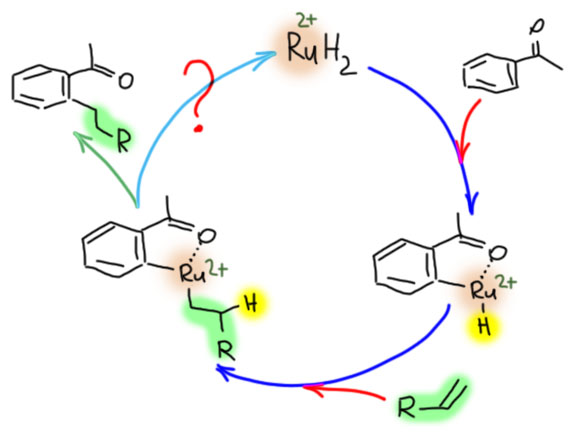
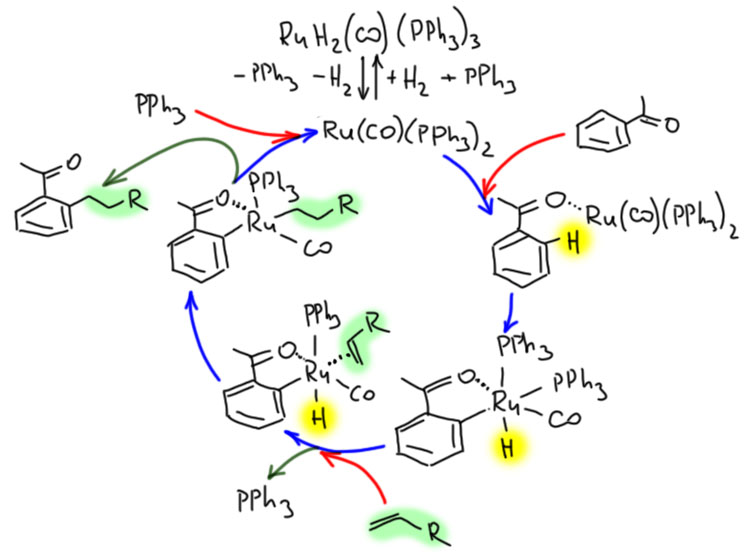
Палладий велик, спорить с этим будет только невежда, но в славном деле CH-активации в новом столетии у него появился опаснейший конкурент. Палладий проспал этот наезд. Он всегда боялся конкуренции со стороны соседа справа – родия. И не без оснований. Родий давно обогнал палладий во всяких промышленных реакциях, и на этом сделался самым дорогим металлом в мире (я имею в виду полезные металлы, а не всякую экзотическую шелупонь, которая дорого стоит только потому что никому не нужна – родий, как и другие благородные металлы торгуется на самой настоящей бирже, и серьёзные люди вкладывают в него последние миллионы). Но в тонком органическом синтезе выскочил вперёд самый скромный из платиновых металлов – рутений. CH-активация на комплексах рутения – одна из самых модных тем в последние 10 лет. Не проходите мимо. Это отчасти похоже на палладий, но здесь всё по-другому, а возможностей не меньше, а больше.
Металлы и их комплексы участвуют и во вполне обычных реакциях, хорошо известных в обычной органической химии, принося в них свои специфические свойства и умения. Одна из таких реакций, весьма популярных в современном синтезе – алкилирование по Фриделю-Крафтсу, типичная электрофильная активация C-H связей. Глянем-ка, что сюда внесли переходные металлы. Что нового увидим на страницах глянцевых журналов с заоблачным импактом.
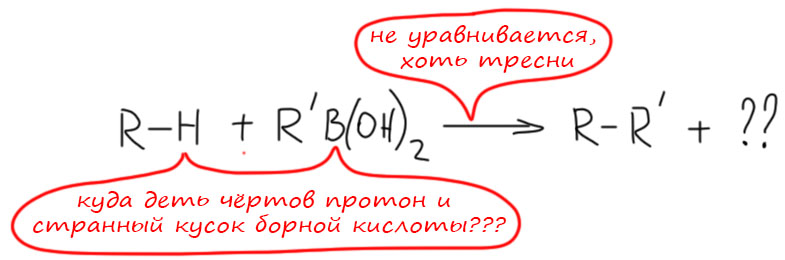
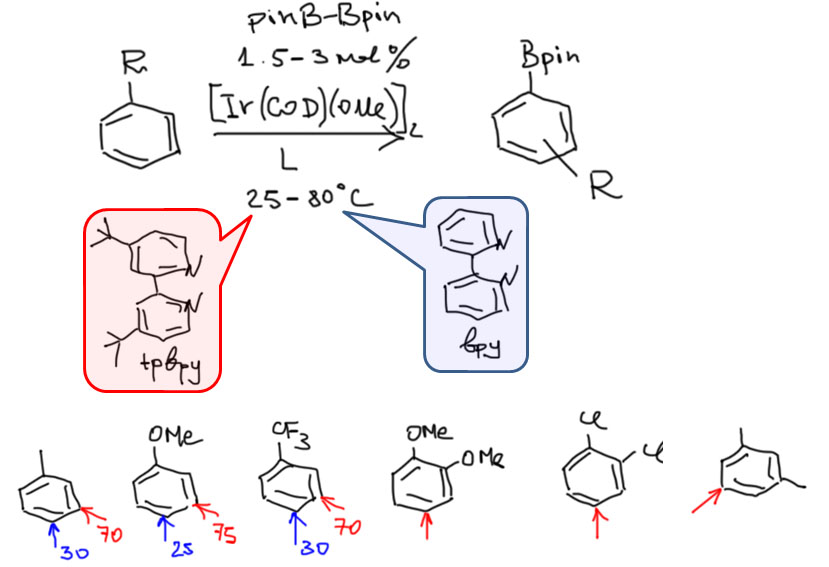
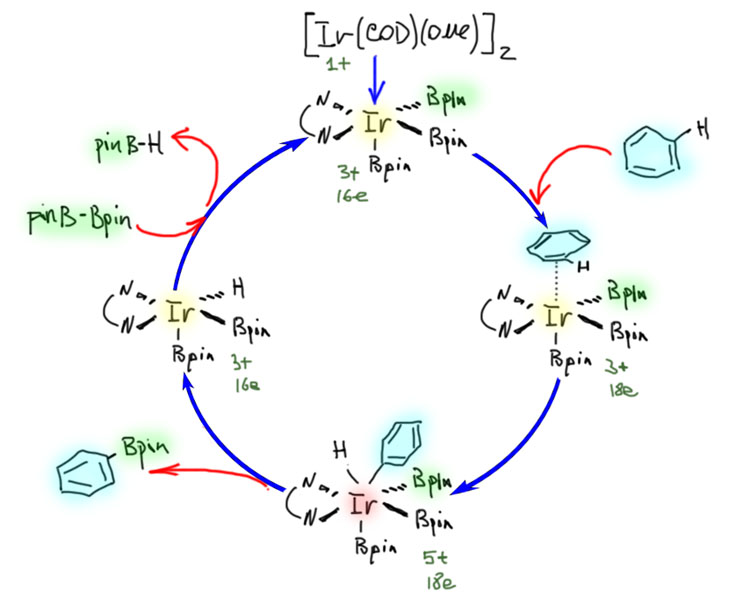
Достижения CH-активации не ограничиваются методами соединения различных углеродных фрагментов, но были открыты и разнообразные и иногда довольно удобные методы введения других групп и заместителей. Особенно важен метод CH-борилирования, ставший невероятно популярным в синтезе из-за удобства и надежности для прямого введения в ароматические кольца борных заместителей далее используемых в кросс-сочетании по Судзуки-Мияуре, и позволивший дотянуться с кросс-сочетанием до самых скрытых мест в больших органических молекулах, для которых невозможно или очень затруднено применение классического кросс-сочетания через введение подходящих уходящих групп.