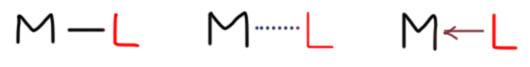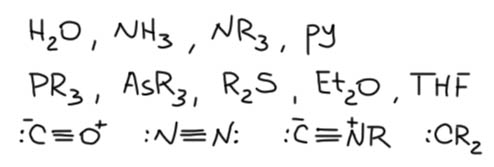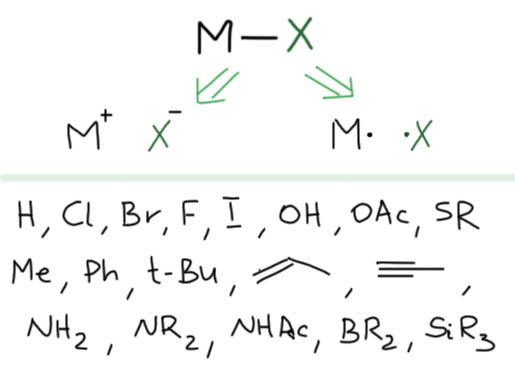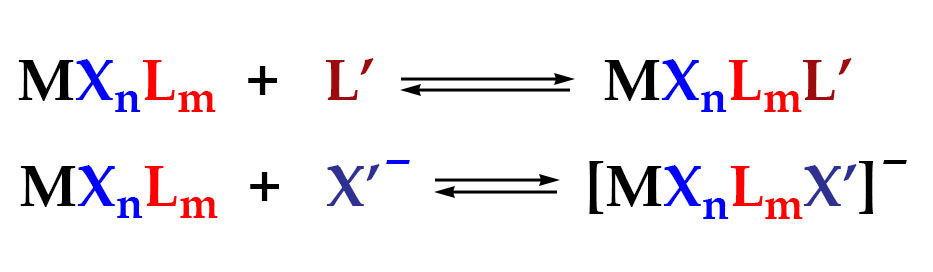Вспоминаем основы координационной химии
В этом курсе мы изучаем применение соединений переходных металлов в органической химии. Можно было бы из этого сделать вывод, что предметом курса является органическая химия, и мы просто добавим к известному арсеналу органических реакций новые реагенты на основе производных палладия, меди, иридия, молибдена, циркония и других переходных металлов, и будем, как это принято в органической химии, смотреть, как эти реагенты решают проблемы органического синтеза, какая у них селективность, диапазон применения, ограничения, и т.д. В классической органической химии именно так: главные задачи – синтез новых органических молекул, усовершенствование синтеза известных молекул. Поэтому и подход такой, ориентированный на синтез. Даже когда мы в органической химии разбираем механизмы, то в основном только для того, чтобы лучше понять синтетические возможности реакций.
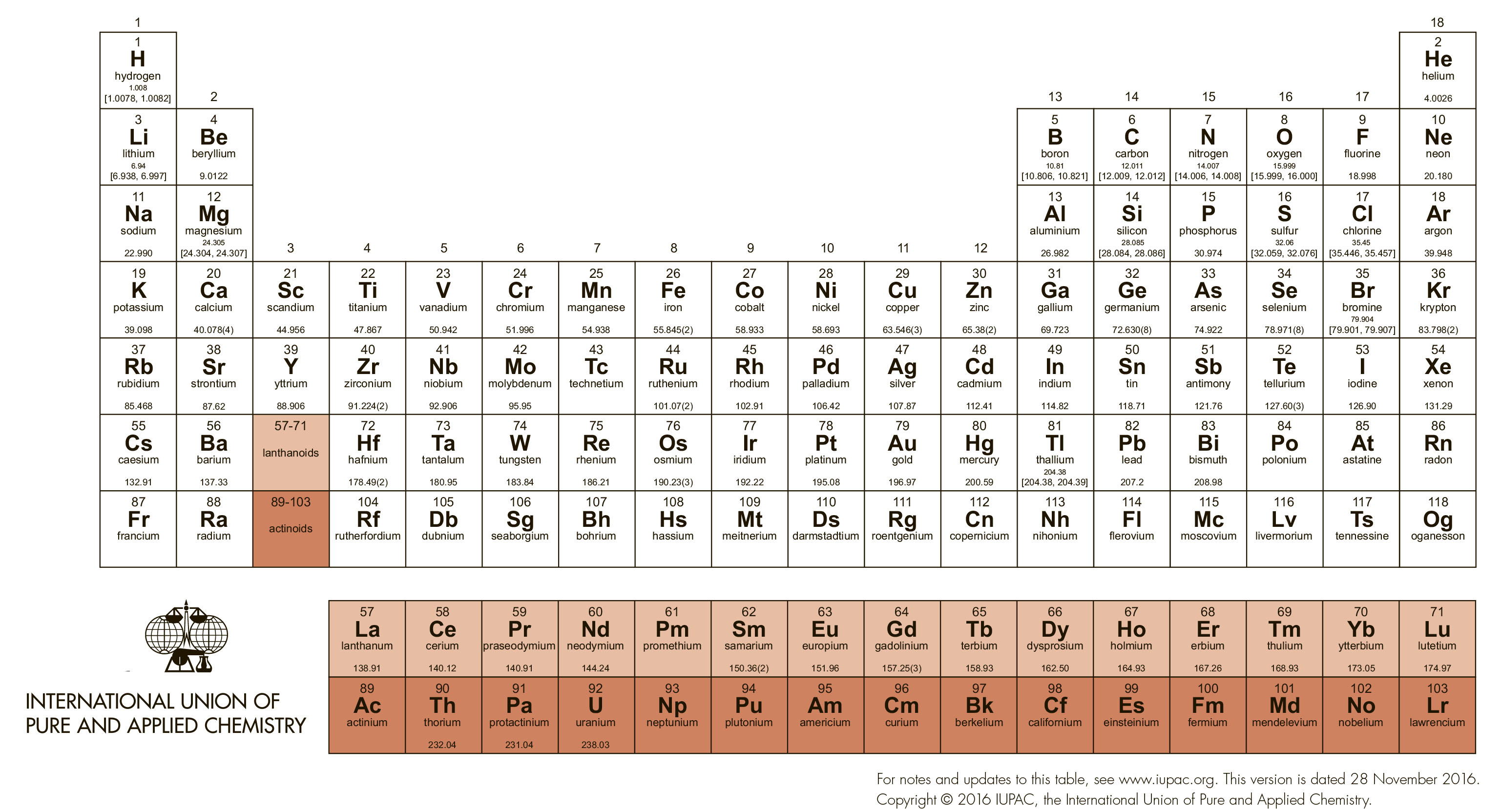
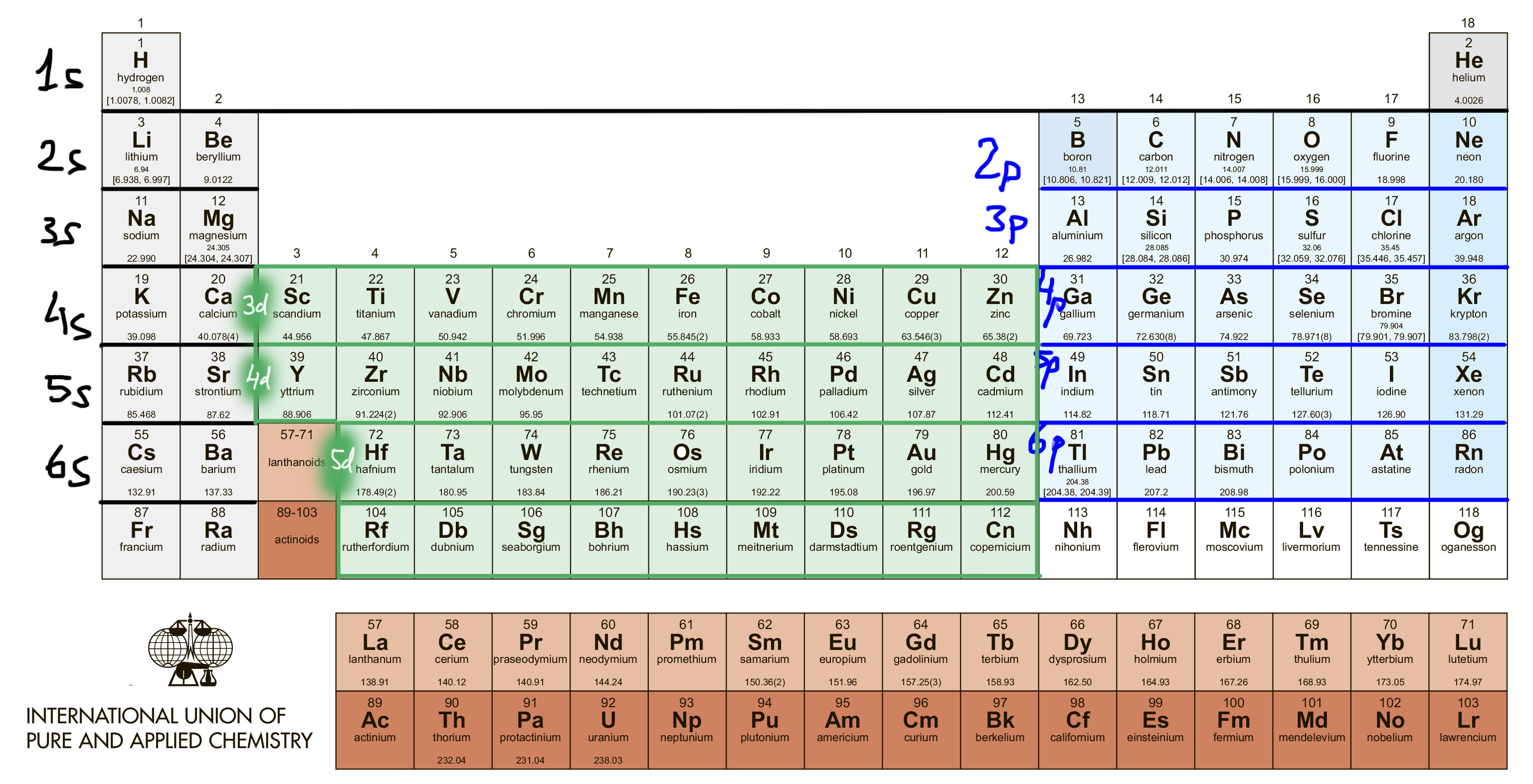
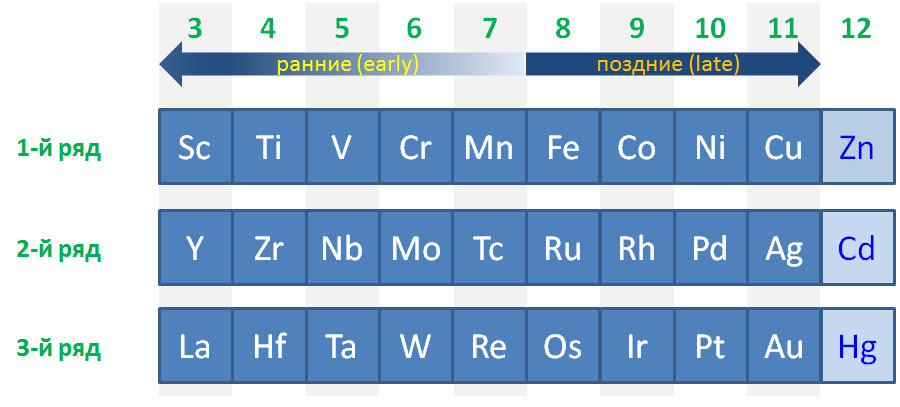
Но в разделе органической химии, основанном на применении производных переходных металлов, этот подход не работает. Проблема в невероятном разнообразии уже введенных в синтез реагентов и катализаторов этого типа. Все известные d-элементы, представленные в Периодической таблице, кроме короткоживущего радиоактивного технеция, задействованы в органическом синтезе десятками и сотнями комплексов разной степени сложности, причем речь идет не об экзотических разработках, опубликованных в одной статье и положенных на полку, а на реально применяемых методах синтеза с десятками-сотнями-тысячами примеров применения. И мы принципиально оставляем за пределами данного курса f-элементы, очень интересные и перспективные, но весьма специфические и требующие отдельного рассмотрения.
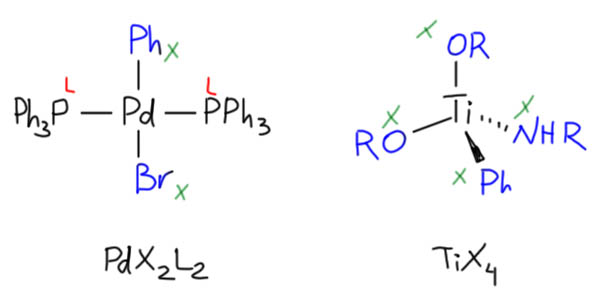
Производные переходных металлов – реагенты и катализаторы – необычны для органиков. Это комплексные соединения, в состав которых входят разнообразные лиганды, от самых простых типа хлорида или пиридина, до ужасающе сложных и, на первый взгляд, совершенно непонятных, ощетинившихся объемистыми замеcтителями многоэтажных фосфинов, гетероциклических карбенов, макроциклов и т.д. Все эти лиганды – не бессмысленные украшения, типа, кто придумает сложнее и рогатее, тот и герой, – а строго определенные по функциям неотъемлемые части реагентов и катализаторов, определяющие селективность, каталитическую активность, реакционную способность, препаративный диапазон, стабильность и тому подобные важнейшие характеристики. Замена одного лиганда на другой часто приводит к драматическому изменению свойств, а сами лиганды подбирают под почти каждую специфическую решаемую задачу. Нет никаких универсальных рецептов, общих методов, рекомендованных методик. Любой химик, планирующий применять комплексы переходных металлов для решения своей задачи, должен понимать, как все это работает, или рискует без пользы потерять кучу времени и денег и намертво разочароваться.
Единственный надежный ключ к этому богатству – координационная химия, химия комплексных соединений. Несмотря на то, что большинство функциональных лигандов – чисто органические соединения, а воспринимаемая невооруженным взглядом сложность, навороченность катализатора или реагента часто сидит в органической части комплекса, эта наука традиционно примыкает к неорганической химии, а не к органической. Степень оскорбления правоверного органика еще усугубляется тем, что так называемые металлоорганические соединения, с точки зрения современной химии, это просто одна из разновидностей комплексных соединений металлов, а следовательно законный предмет изучения координационной и неорганической химии. В этом несложно убедиться, заглянув в свежий или не очень свежий номер любого из известных неорганических журналов с хорошей и долгой историей: Inorganic Chemistry, Dalton Transactions, Inorganica Chimica Acta, European Journal of Inorganic Chemistry – в глазах будет рябить от явно органических молекул. Но методология, использованная в статьях, будет другой, непривычной органикам – это терминология и методология координационной химии, которая крутится вокруг металла, а лиганды рассматривает не с точки зрения их органической природы, а скорее как управляющие элементы, настраивающие центральный металл на исполнение какой-то важной роли.
Поэтому и мы тоже углубимся в предмет с этой стороны. Нас вообще не будет интересовать, откуда берутся те или иные лиганды и как их синтезируют, но будет интересовать, как устроена химия комплексов, что в ней определяется центральным металлом, а что лигандами. И начнем мы с того, что просто вспомним то, что наверняка проходили хотя бы на 1 курсе, а возможно и в рамках каких-то спецкурсов, – с основ координационной химии. Многие все это и так знают наизусть и с самого раннего детства – ну, тогда просто пропустите, или даже полистайте, возможно, что-то все-таки забыли, и будет полезно напомнить.
Сразу предупреждаю, что в данном курсе будет сведено к минимальному минимуму все, связанное с квантовой картиной химии, не будет даже теории кристаллического поля, не говоря уж о корректно нарисованных МО комплексов и результатов DFT расчетов. Все это очень важные и полезные вещи, и, начиная с некоторого уровня, без них не обойтись. Но практика показывает, что вполне удовлетворительное описание свойств и реакций комплексов переходных металлов с акцентом на использование в органической химии можно получить и без этой артиллерии. Может быть, потом добавим, если появится потребность. А пока ограничимся только самыми простыми сведениями о том, как устроены комплексы и связи.
И в этом и во всех других разделах информация будет устроена так: сначала некоторое подобие слайдов, приблизительно соответствующее лекционному материалу, и у многих слайдов будет кнопка, отсылающая к более подробному описанию. В конце появятся задачи на усвоение и понимание материала темы.
Координационные, комплексные, металлоорганические соединения
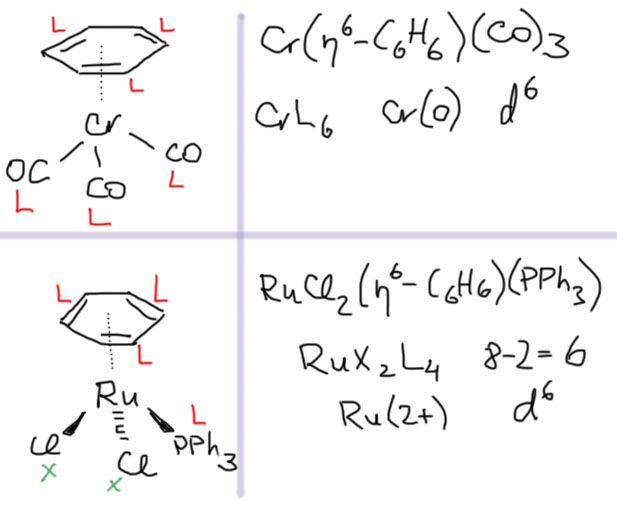
Химия, которой мы будем заниматься, требует участия производных переходных металлов или как катализаторов, или как стехиометрических реагентов. Производные переходных металлов – не все вообще, но те, которые нас будут интересовать – всегда устроены по одной схеме: атом металла и вокруг него органические или неорганические лиганды. Такие соединения принято называть координационными соединениями. Есть ещё старый термин “комплексные соединения”, восходящий к работам Альфреда Вернера, получившего за это Нобелевскую премию в 1913. С нашей точки зрения разницы между этими терминами нет. Мы будем называть соединения переходных металлов и комплексами переходных металлов, и координационными соединениями переходных металлов. В более строгом смысле разница есть, и термин “координационные соединения” имеет более общий смысл.
Металлоорганическими соединениями называют координационные соединения, в структуре которых есть хотя бы одна связь металл-углерод, любого типа (ионного, координационного, ковалентного).
Простые лиганды
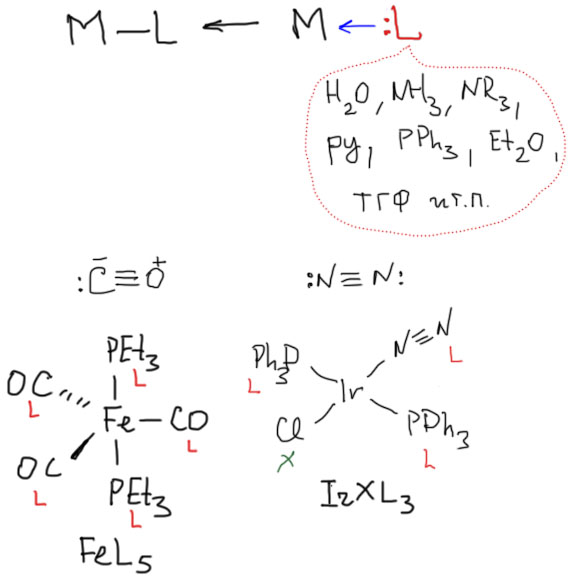
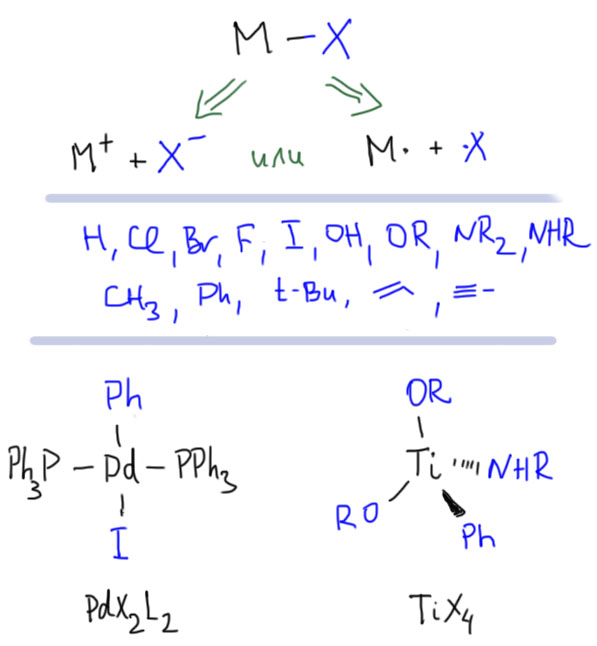
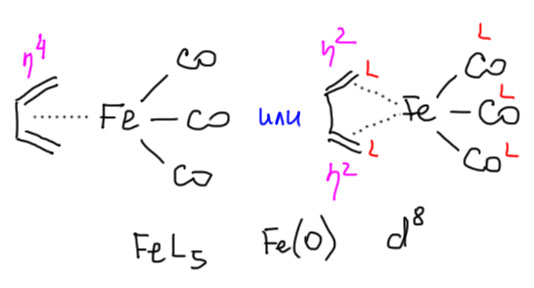
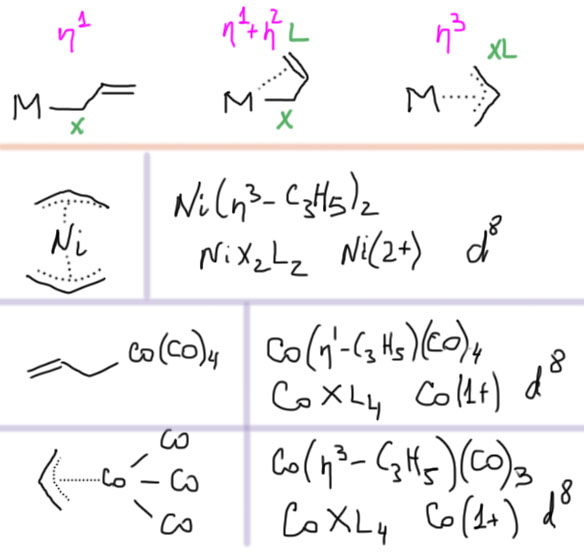
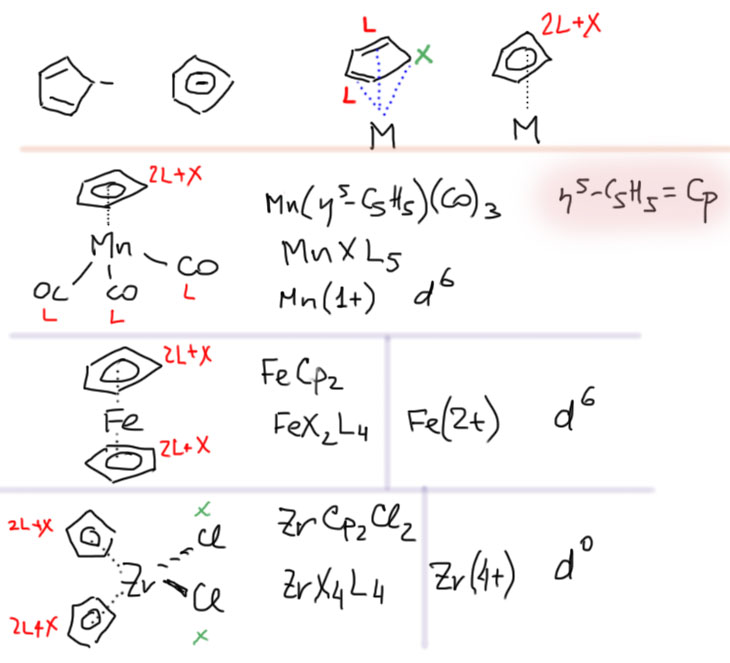
Теперь займемся лигандами. Простые лиганды связаны с атомом металла всегда через один атом, то есть в комплексе всегда просто и однозначно можно найти связи металл-углерод, металл-водород, металл-галоген, металл-кислород, металл-азот и т.п. какой бы громоздкой и сложной молекулой ни был бы сам лиганд.
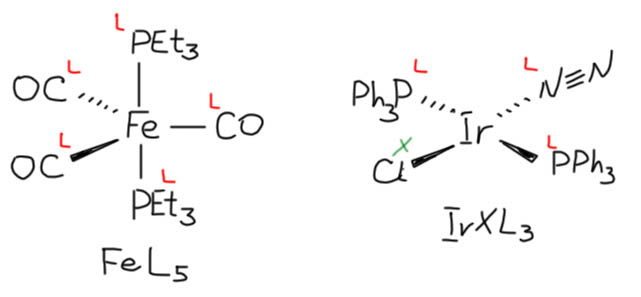
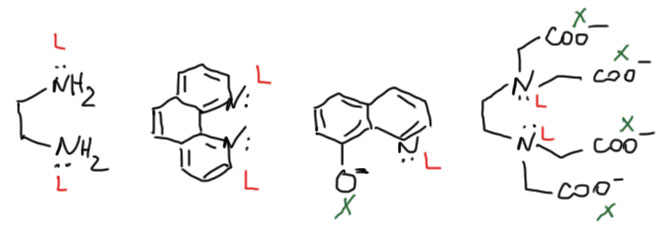
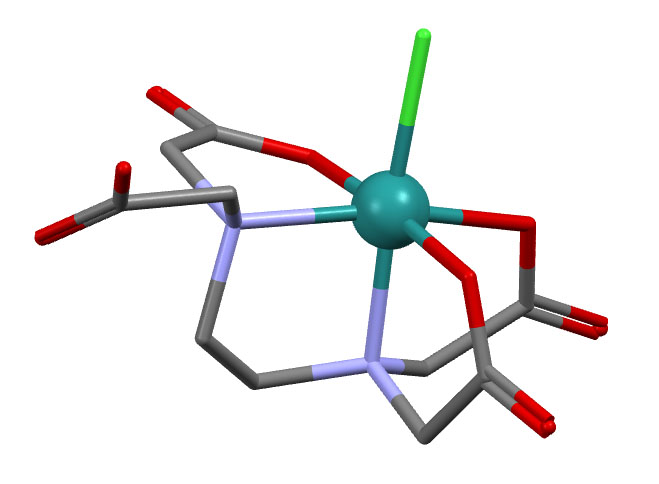
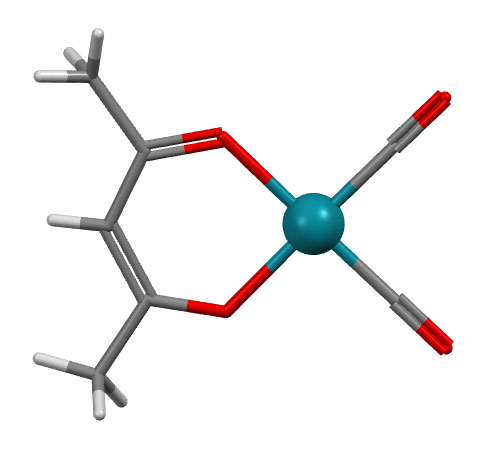
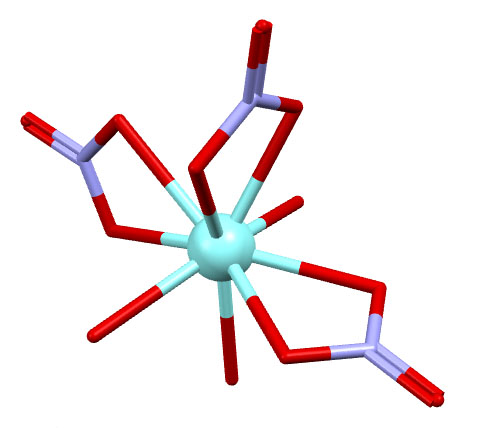
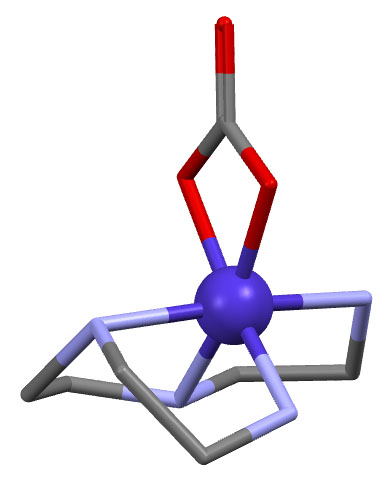
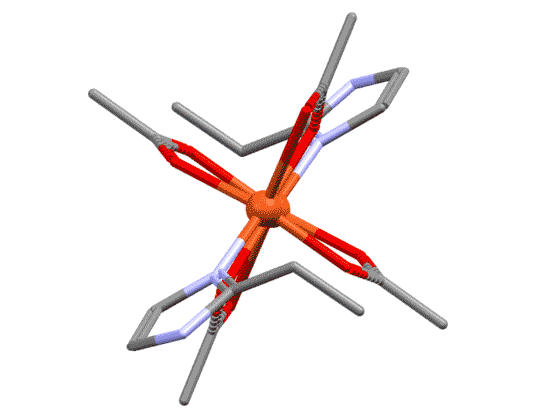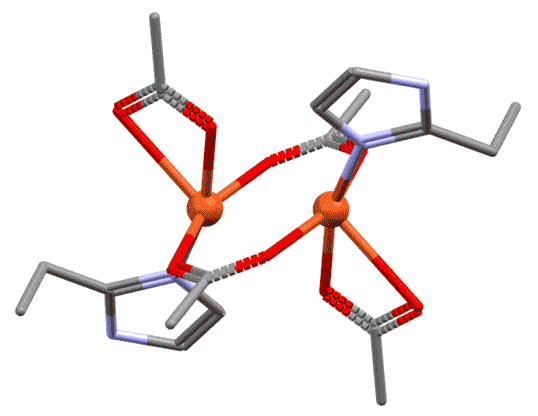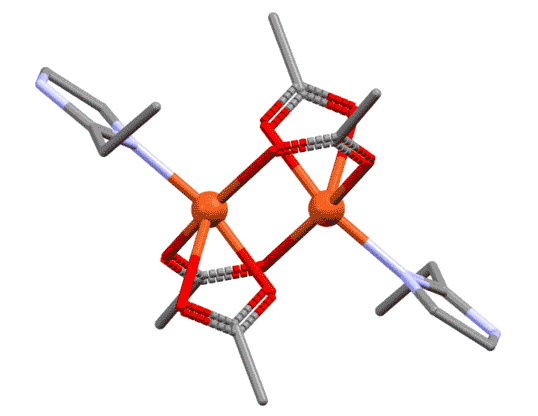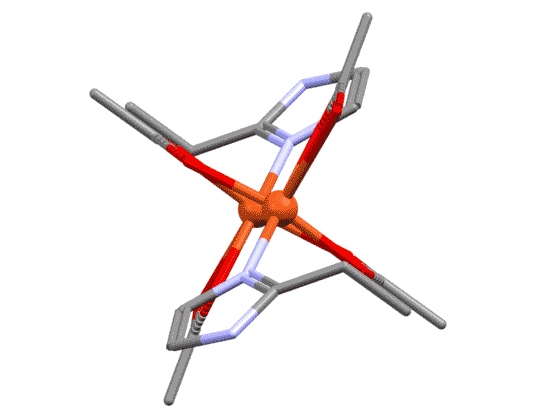
Простые (и не только) лиганды можно соединять в одной молекуле, собирая их с помощью более или менее гибкого органического (не обязательно!) фрагмента. Такие молекулы с несколькими координационными центрами называют полидентатными лигандами (бидентатными, тридентатными и т.д.). Такой большой многоцентровой лиганд может связываться с одним атомом металла, образуя комплекс-хелат. Или с двумя и более атомами металла, образуя многоядерный комплекс или кластер. Комплексы хелатного типа, а следовательно и сами такие лиганды играют колоссальную роль в органических реакциях, а придумывание таких лигандов и комплексов составляет одну из основных форм деятельности в данной области. Для поднятия самооценки этот в значительной степени хаотический мыслительно-экспериментальный или экспериментально-мыслительный процесс любят называть дизайном, намекая на строго целенаправленный характер этой деятельности.
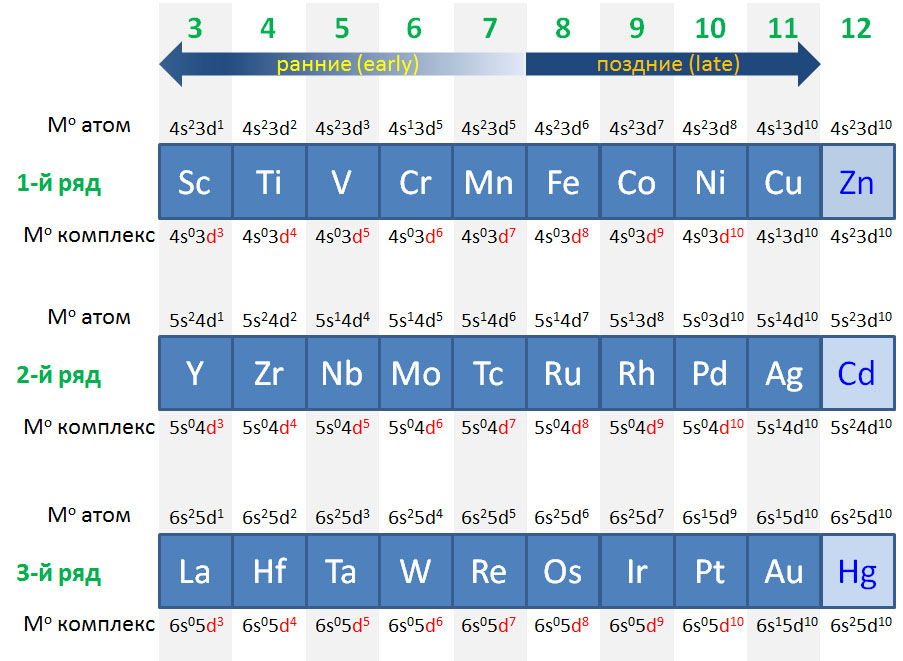
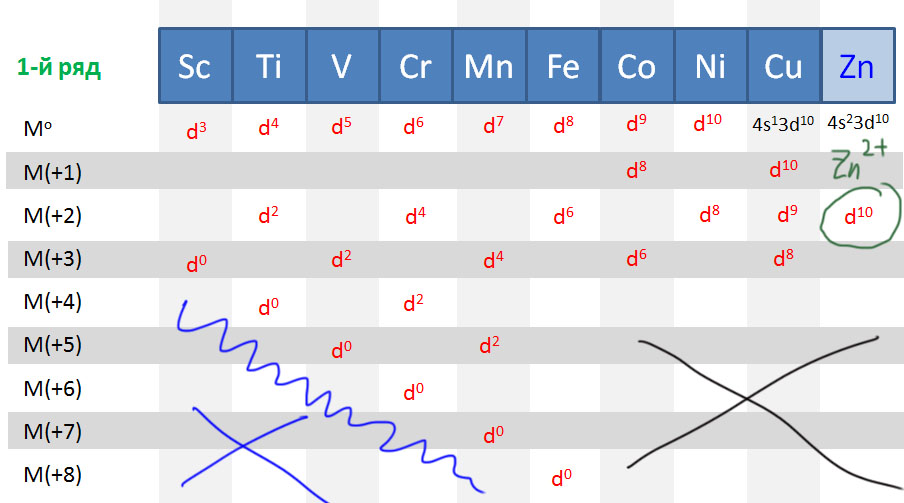
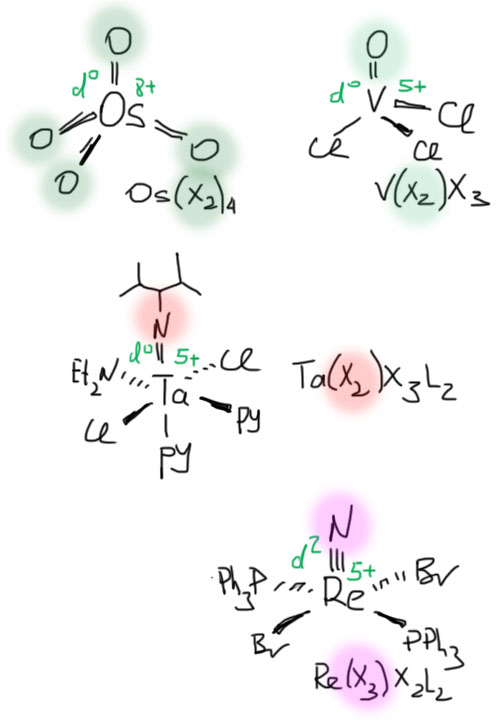
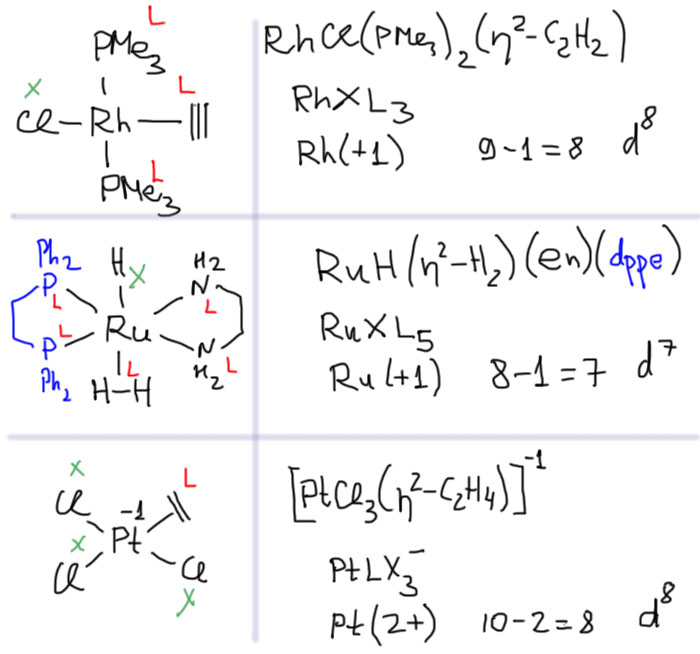
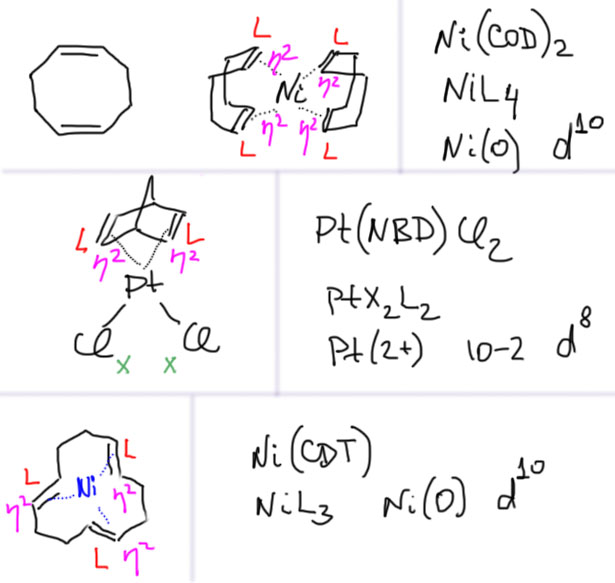
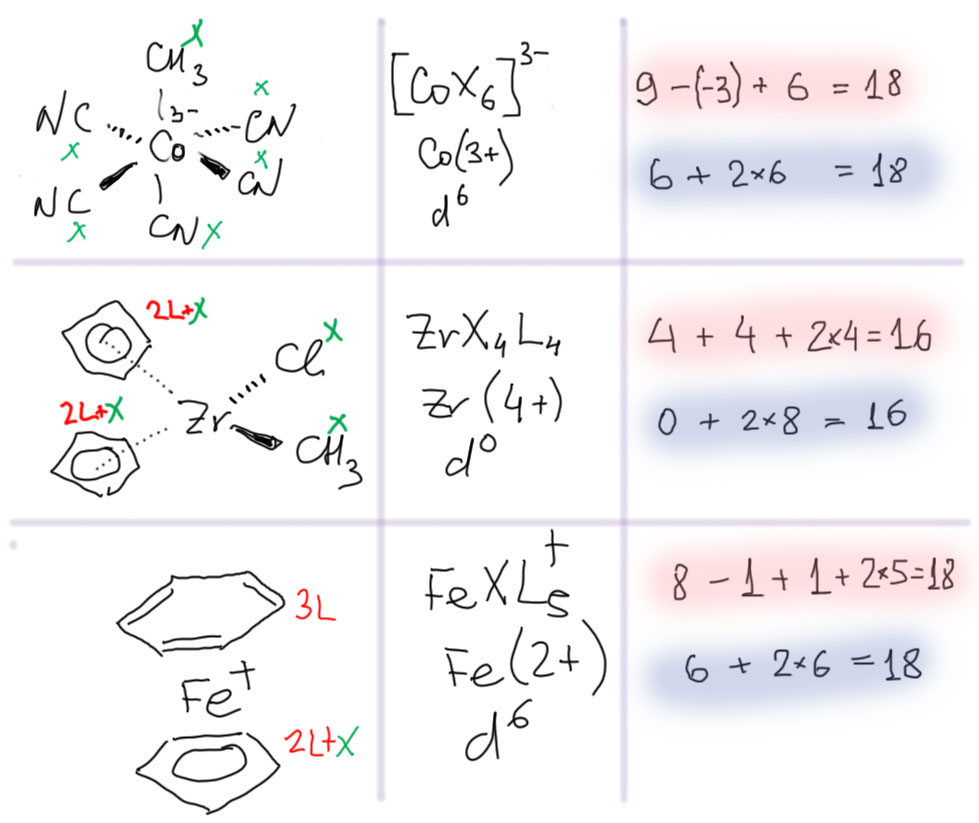
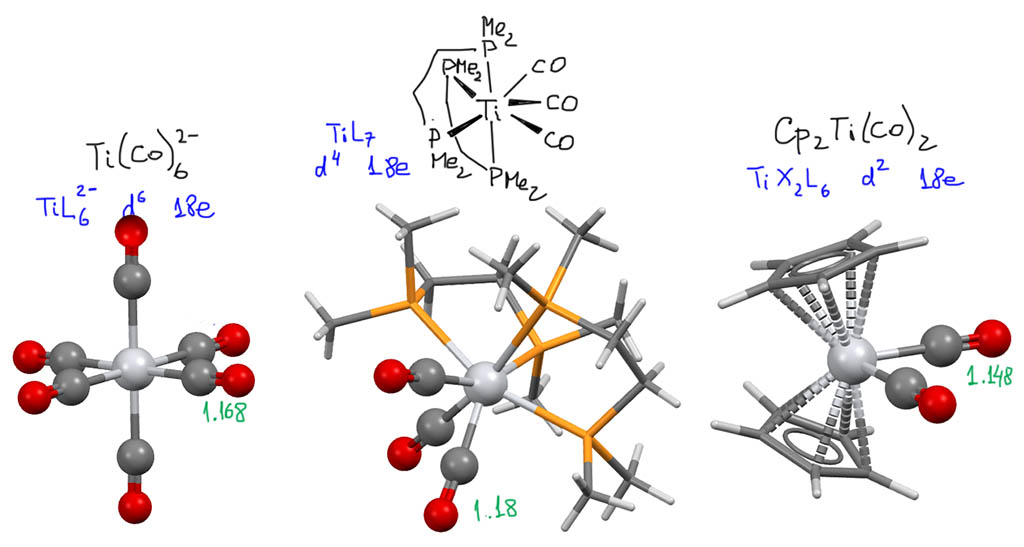
С металлами и лигандами разобрались – теперь попробуем собрать все вместе в комплекс (координационное соединение), и попробуем посчитать электроны, вовлеченные в образование таких молекул, и посмотрим, что из этого получится. Считать придется по очень строго сформулированному правилу, которое гарантирует, что будет получаться одно и то же, кто бы ни считал. Из такого счета получается знаменитое и очень полезное правило 18-электронное правило.
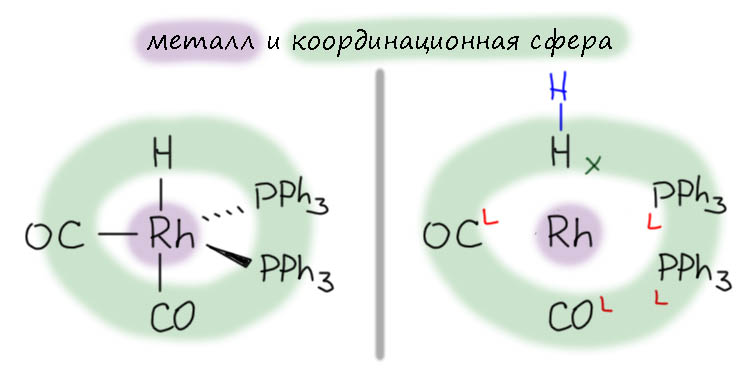
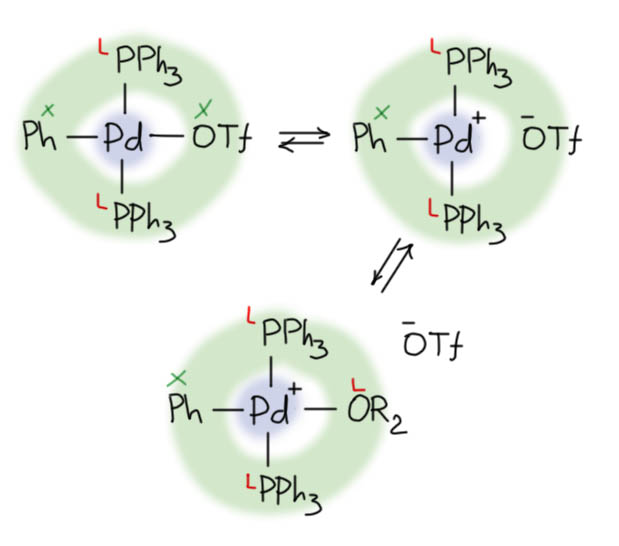
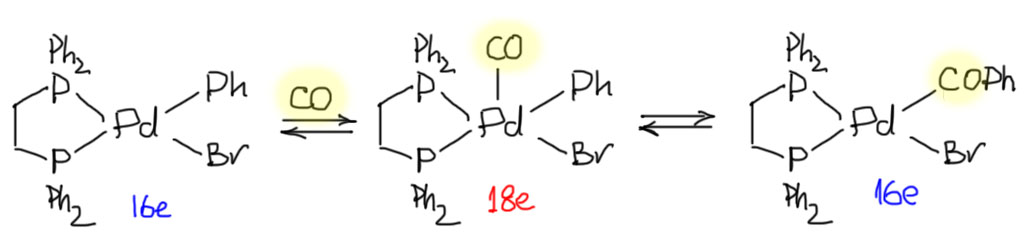
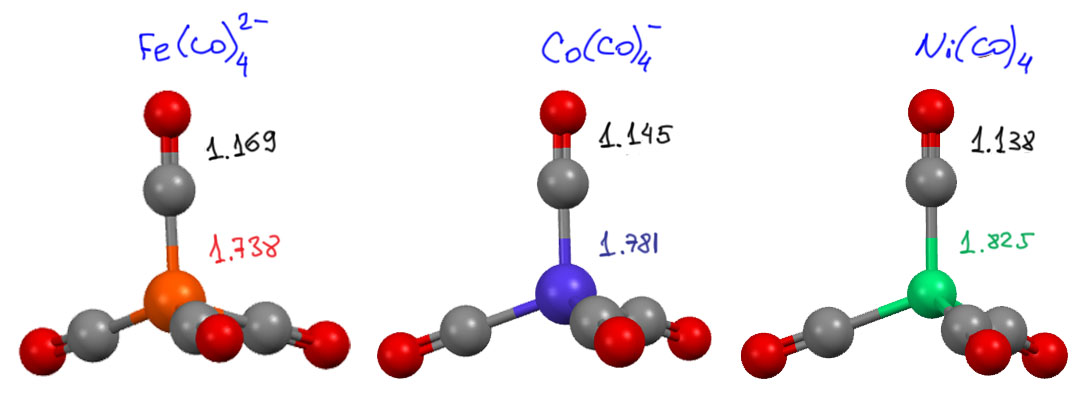
Одно из важнейших следствий счета электронов – представление о том, что 18-электронные комплексы не только встречаются чаще всех остальных, но и обладают интересной особенностью – координационной насыщенностью, то есть принимают максимально возможное число лигандов для данного валентного состояния металла. Если есть координационная насыщенность, то есть и координационная ненасыщенность – состояние, подразумевающее возможность изменения количества лигандов на металле, а это совершенно необходимо для того, чтобы комплекс металла мог участвовать в химической реакции, связанной с изменением лиганда. А это именно то, что нам нужно для того, чтобы стало возможным то, о чем мы будем говорить в этом курсе.
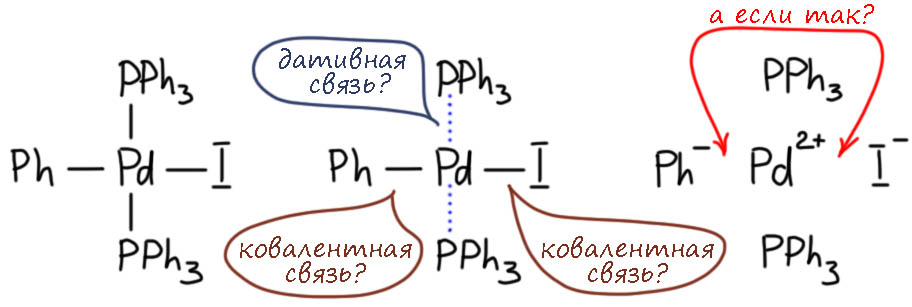
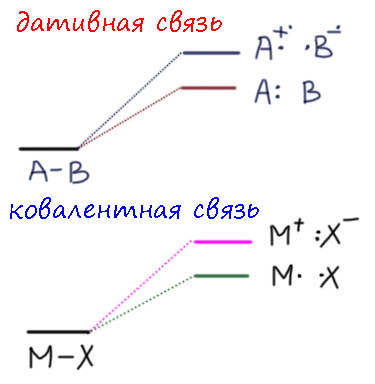
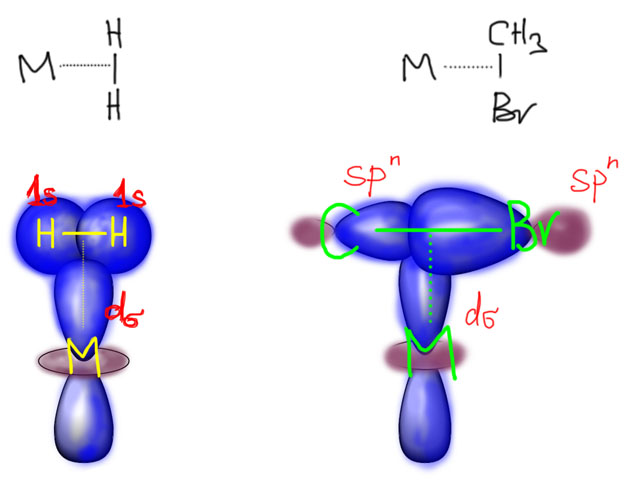
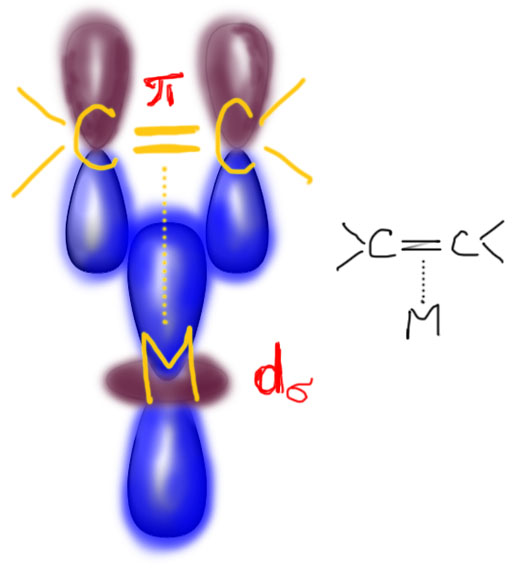
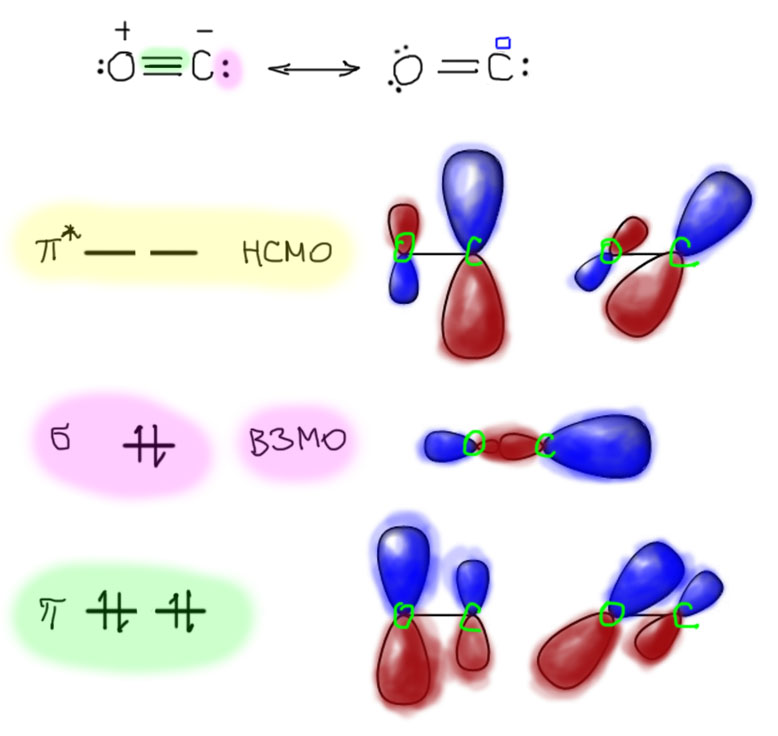
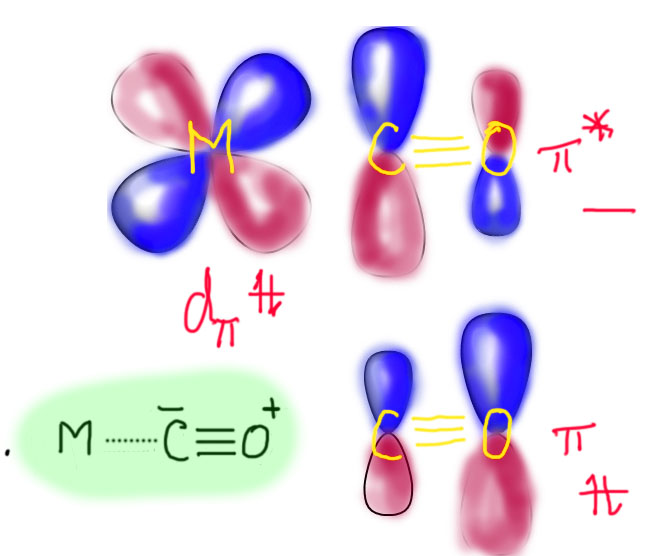
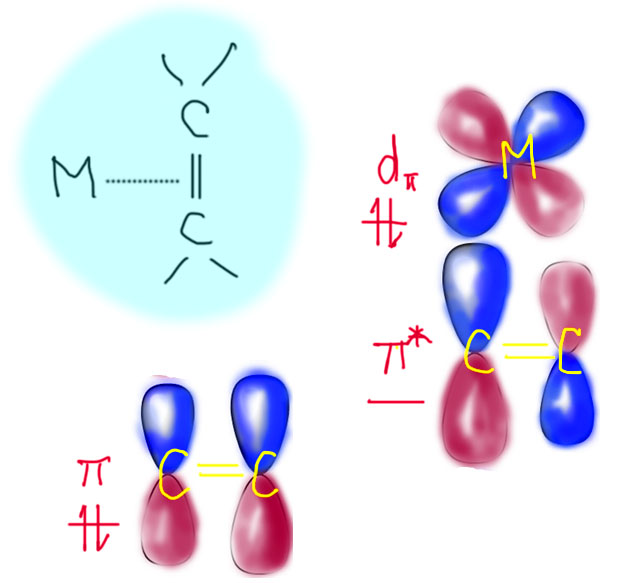
В связях металлов с лигандами часто присутствует и дополнительное взаимодействие, называемое по-английски back donation, за счет взаимодействия заполненных орбиталей металла dπ-типа с вакантными орбиталями лиганда, подходящими по симметрии, а это обычно разрыхляющие π-орбитали. Это взаимодействие играет совершенно колоссальную роль как в структурах комплексов, так и в их реакционной способности. В каком-то, а точнее, во вполне определенном смысле это взаимодействие является ключевой причиной того, что лиганды в координационной сфере металла приобретают новую реакционную способность, и вступают в разнообразные реакции. Можно даже сказать, что если бы не было этого эффекта, не было бы и этого курса лекций, потому что не о чем было бы рассказывать.