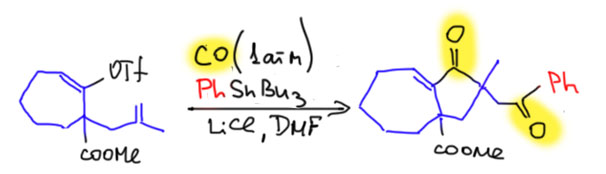
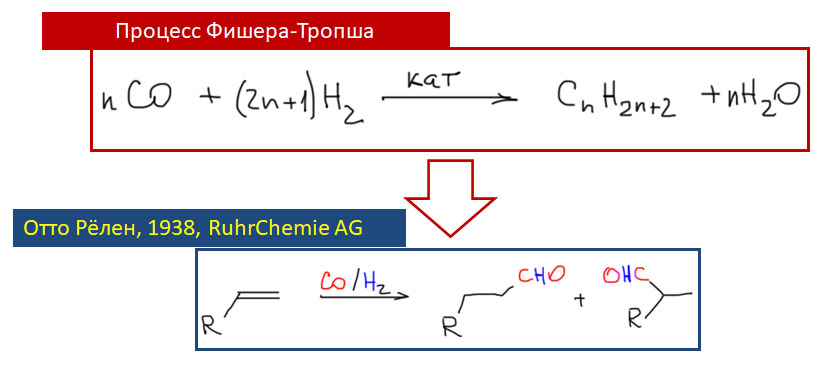
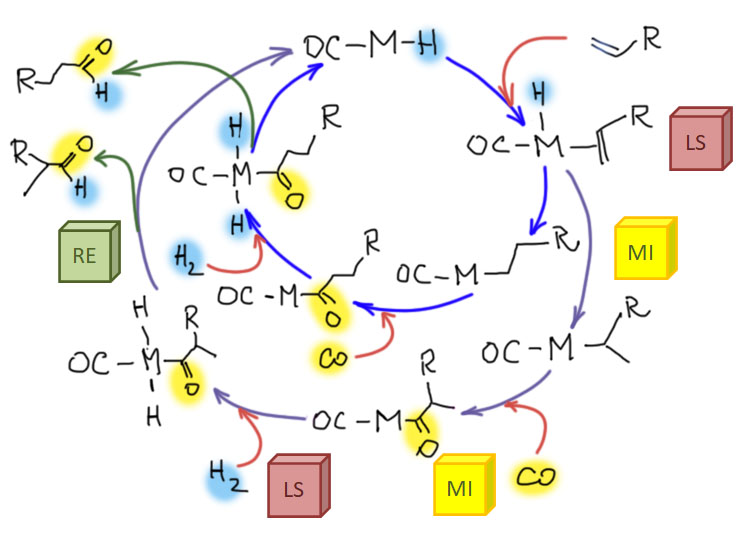
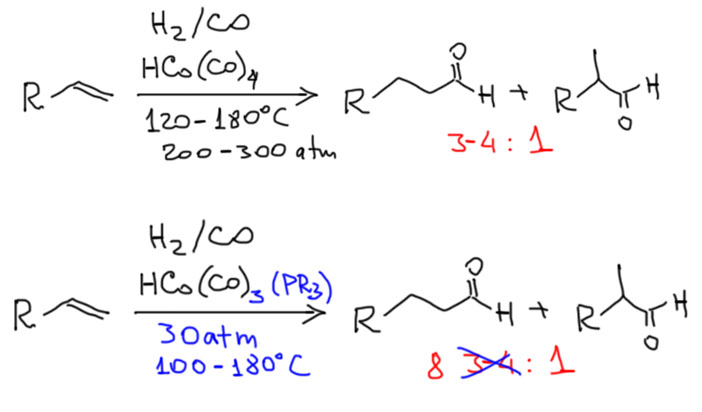
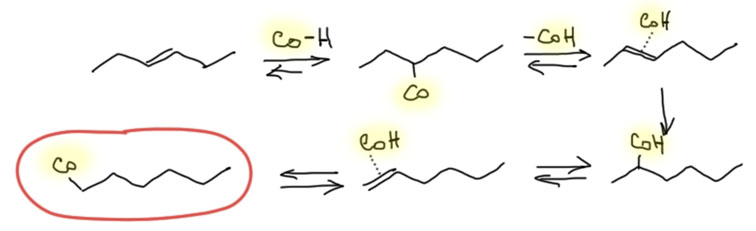
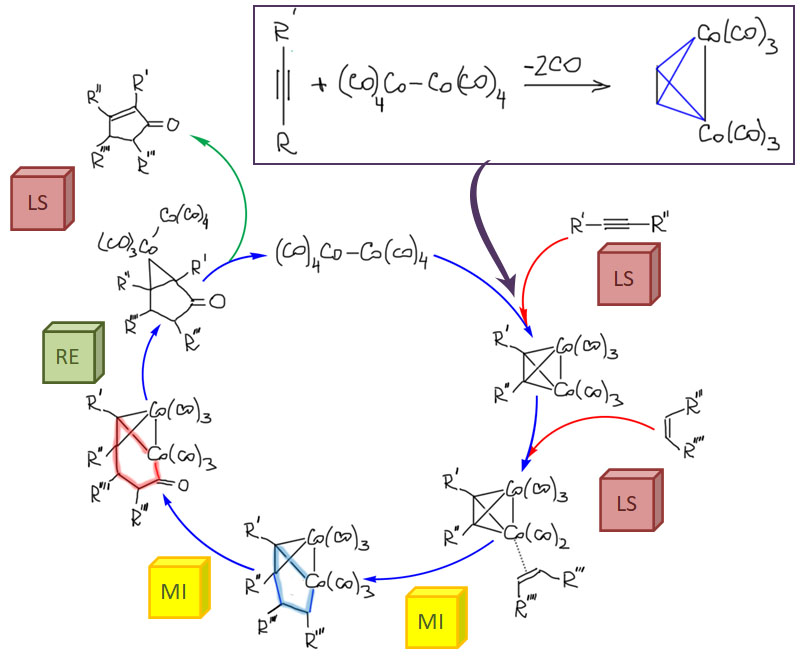
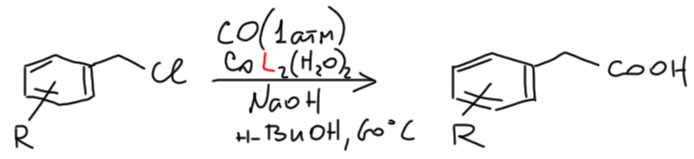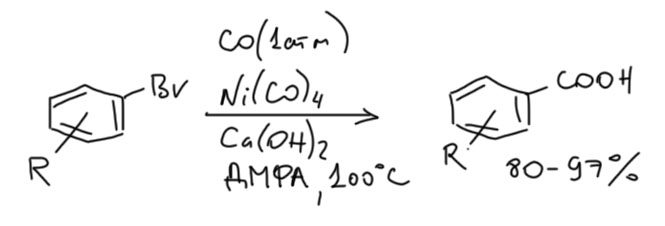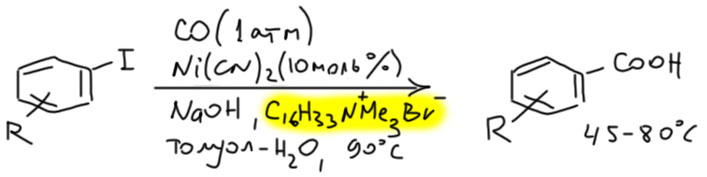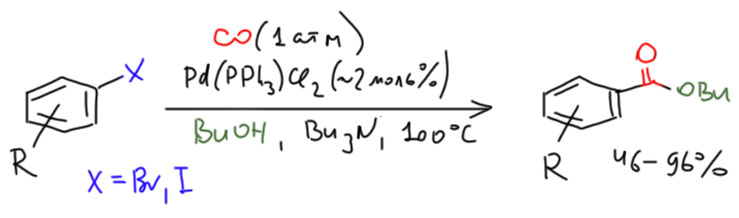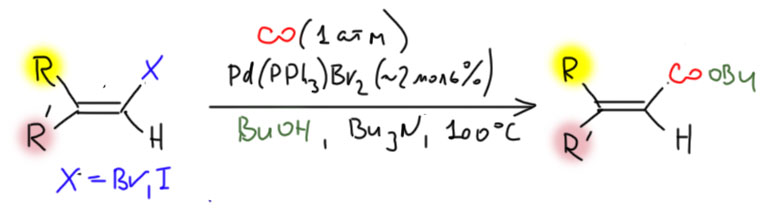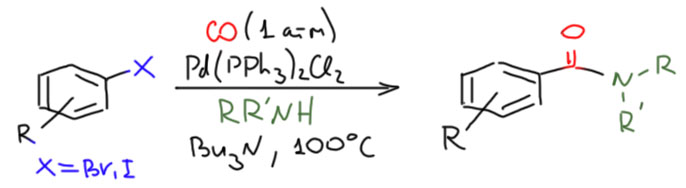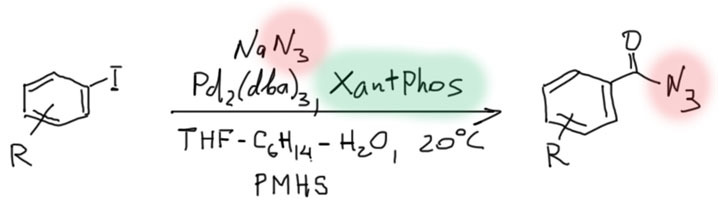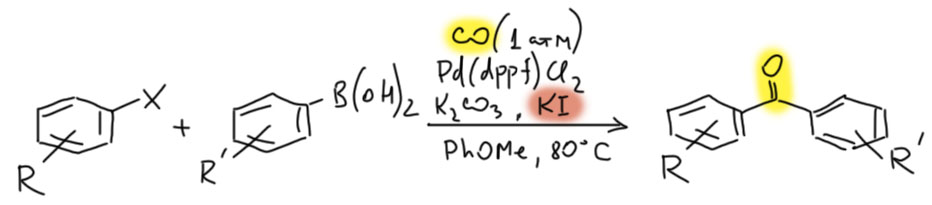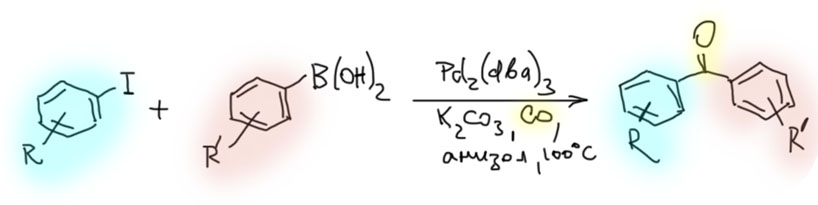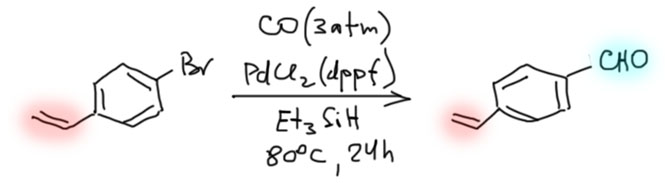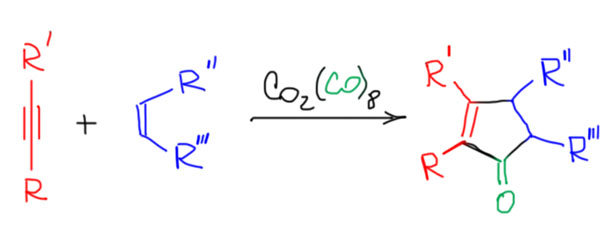Реакции с участием оксида и диоксида углерода
Углерод как элемент тверд и поэтому малопригоден для нормальных реакций, так как образует в твердой фазе бесконечные двухмерные или трехмерные цепочки прочно связанных друг с другом атомов, которые нужно сначала как-то контролируемо разрушать. Это требует огромных затрат энергии, и, соответственно, условий, трудносовместимых с нормальными реакциями синтеза. Для того, чтобы участвовать в хороших, то есть разнообразных и синтетически продуктивных реакциях, углерод должен быть превращен во что-то простое, но более доступное в виде отдельных молекул, на которые можно культурно воздействовать реагентами и катализаторами. Самые простые молекулярные представители элемента углерода – оксид и диоксид углерода, а также метан. Эти три соединения составляют то, что часто называют C1-химией, имея в виду, что преобразование одноуглеродных молекул в более сложные – достойная задача органического синтеза, позволяющая воспроизводить все многообразие органических молекул из очень простой и практически неограниченной сырьевой базы. Мы отлично знаем, что с этой задачей превосходно справляются бактерии и растения, и нам как-то неудобно считать себя синтетиками низшего порядка по сравнению с ними, хотя это действительно так и есть, и было бы мудрее смириться. Про метан мы поговорим отдельно, а здесь займемся оксидами углерода.
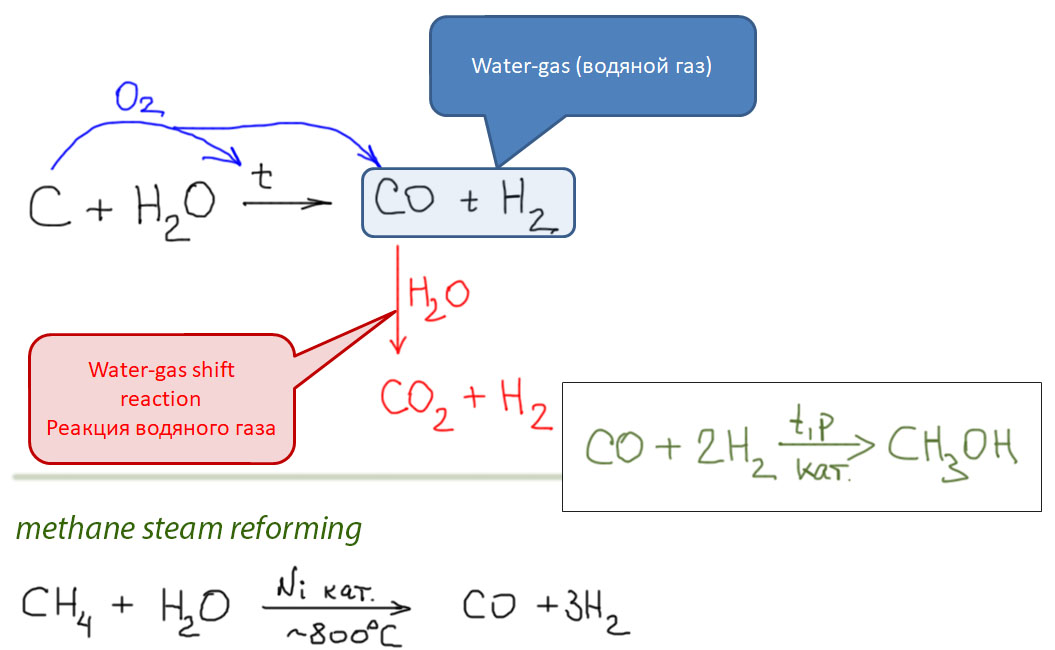
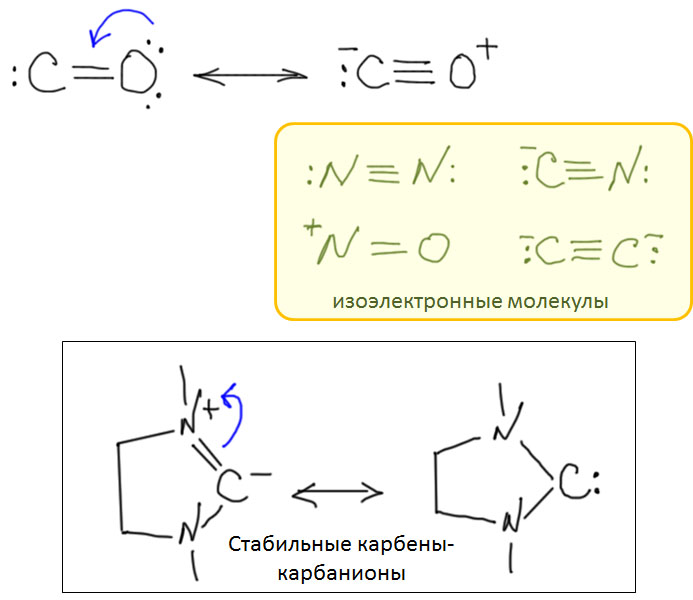
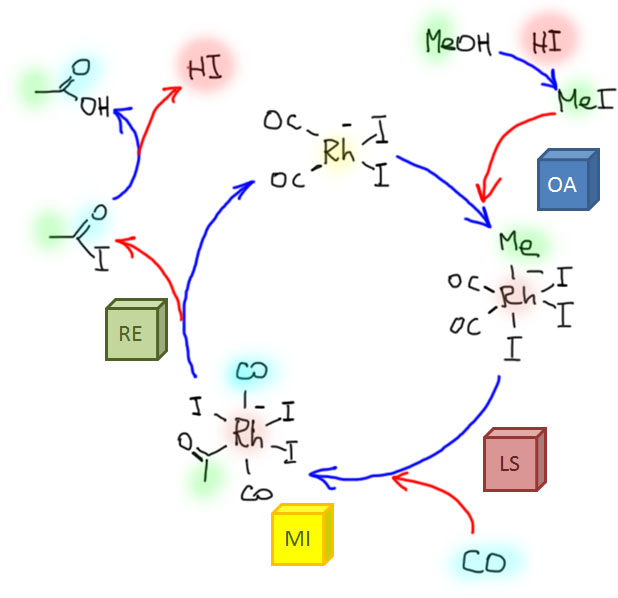
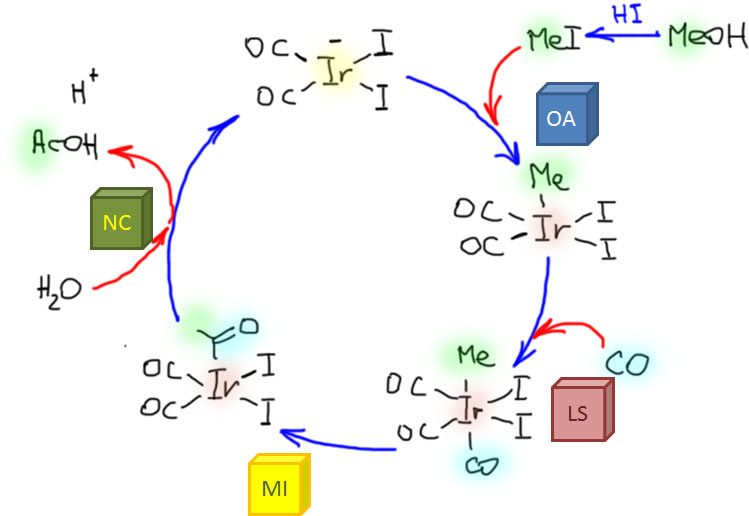
Из двух обычных оксидов углерода, монооксид CO обладает невероятно высоким авторитетом в химии переходных металлов. Оксид углерода или просто карбонил – один из самых важных и наиболее подробно исследованных лигандов, а реакции этой простой молекулы многочисленны и разнообразны. Это само по себе отлично, но есть одна проблема – оксид углерода не является непосредственно доступным производным углерода – он, к счастью, не встречается на планете Земля в ощутимых количествах, его нужно делать из угля (в промышленности), или муравьиной кислоты (в лаборатории). Это вещество весьма токсично, при этом оно не обладает ни вкусом, ни запахом, что делает его чрезвычайно опасным – люди незаметно травятся оксидом углерода насмерть. В лабораториях и промышленных помещениях, где работают с оксидом углерода, используют всякие способы распознать опасную концентрацию, от автоматических датчиков до бумажек, пропитанных солями палладия. Дурная слава незаметного убийцы, тянущаяся за этим веществом, лишает многих всякого желания встречаться с ним в работе и жизни. В лабораторных условиях существует множество способов генерировать CO прямо в реакционной смеси из более безобидных или, по крайней мере, осязаемых веществ, но дискомфорт все равно остается.
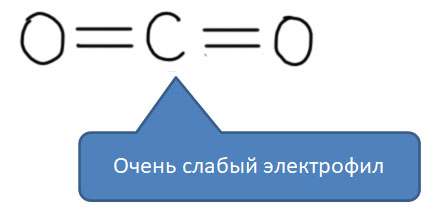
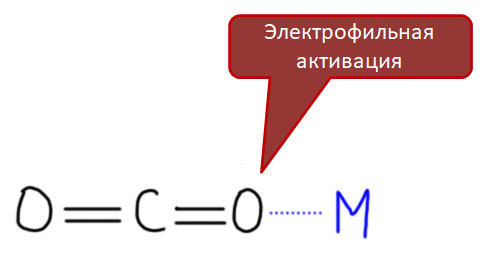
Диоксид углерода в смысле доступности и опасности отличается от CO радикально. Колоссальные количества этого вещества находятся в атмосфере и ежесекундно вырабатываются при сжигании топлива и жизнедеятельности живых организмов. Проблема глобального потепления как раз и связана с повышением концентрации диоксида углерода в атмосфере, и извлекать его оттуда было бы очень выгодно. На самом деле, это было бы так, только если бы это удавалось делать в совершенно циклопических масштабах и только в том случае, если бы эта деятельность происходила бы за счет энергии возобновляемых источников. Поскольку ни о том, ни о другом речь не идет, нам остается только удовлетвориться обычной отговоркой, что с чего-то нужно начинать. Диоксид углерода нельзя назвать совсем безопасным газом, и лишиться жизни с его помощью тоже можно, но все же и концентрация для этого потребуется на порядки более высокая, и накопление реально опасных концентраций этого газа требует особых условий – замкнутых помещений, и почти полного отсутствия газообмена. Недавняя трагедия в бассейне, куда для понта вывалили мешок сухого льда, показывает, как легко организовать такую бойню с помощью с виду безобидного прикольного материала. Химики хорошо знают, что каждые 44 грамма твердой углекислоты выделяют в воздух 22.4 литра газообразной, и если мы сдуру быстро испарим всего 4.4 кг получим два с лишним кубометра. Откачать не успевают – CO2 растворяется в крови и изменяет кинетику переноса кислорода гемоглобином. Казус известных пещер вокруг супервулкана Флегрейских полей в окрестностях Неаполя, где плохо себя чувствуют маленькие собаки, а люди даже не замечают проблем, показывает еще одно спасительное свойство этого тяжелого газа – он скапливается в опасных концентрациях только снизу. В общем, если не делать глупостей – не реагент – мечта! Еще и приплачивать будут, если вы его куда-нибудь засунете. Увы, это оказывается настолько непросто, что реальных успехов в химии диоксида углерода пока что кот наплакал. Почему все так печально, посмотрим, когда доберемся до этой интересной, но немного импотентной молекулы.
Начнем с оксида углерода.
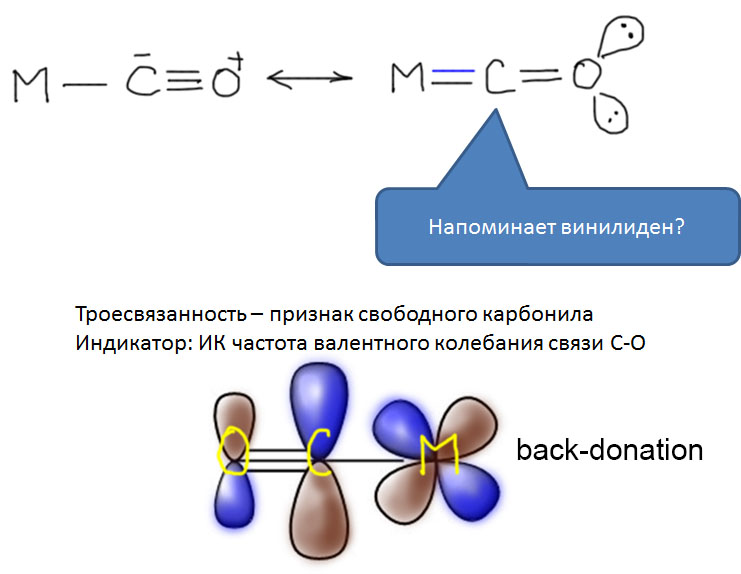
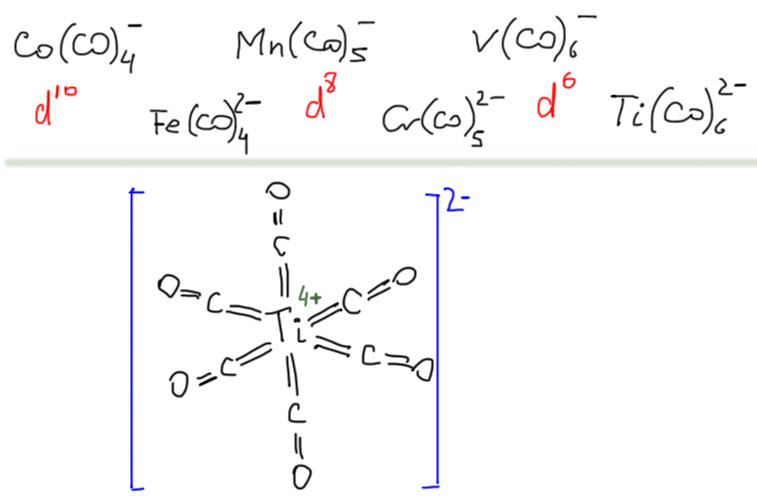
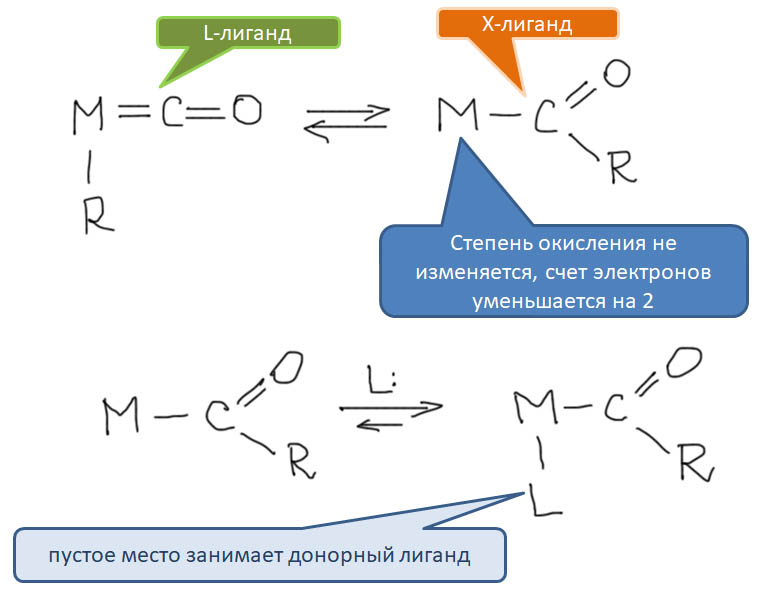
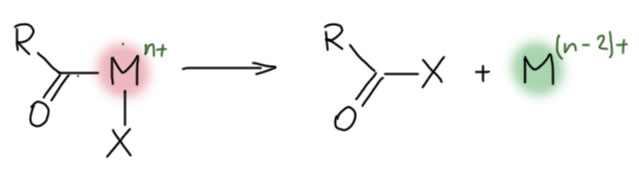
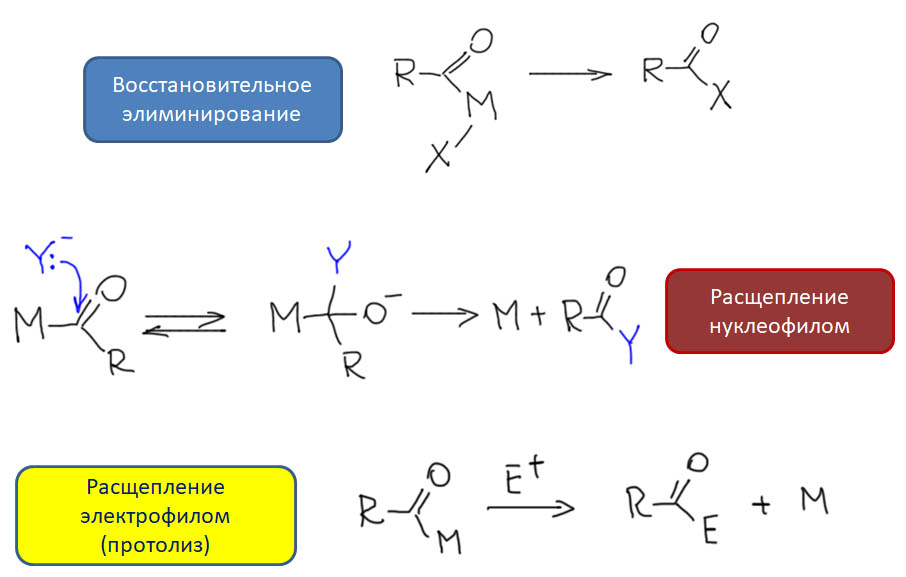
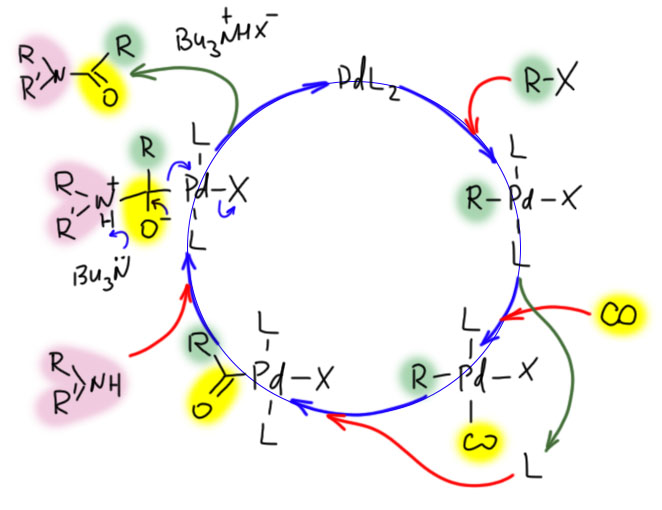
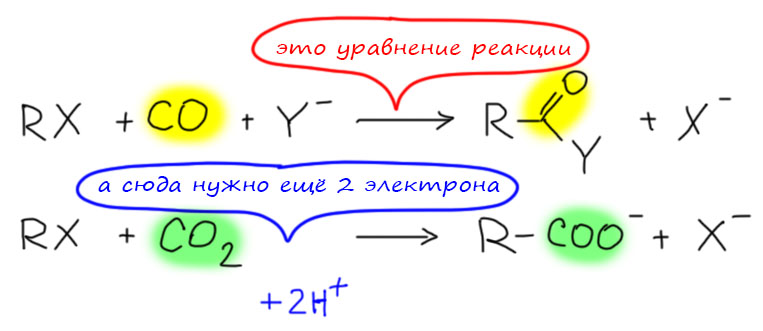
Итак, CO легко входит в координационную сферу переходных металлов, как правило, образуя карбонильные комплексы с моногапто-связыванием молекулы CO через углерод. Другие типы связывания – и дигапто-, и мостиковые – тоже бывают, но играют относитеьно небольшую роль в реакциях с участием органических соединений. Посмотрим, что происходит дальше, уже в координационной сфере.
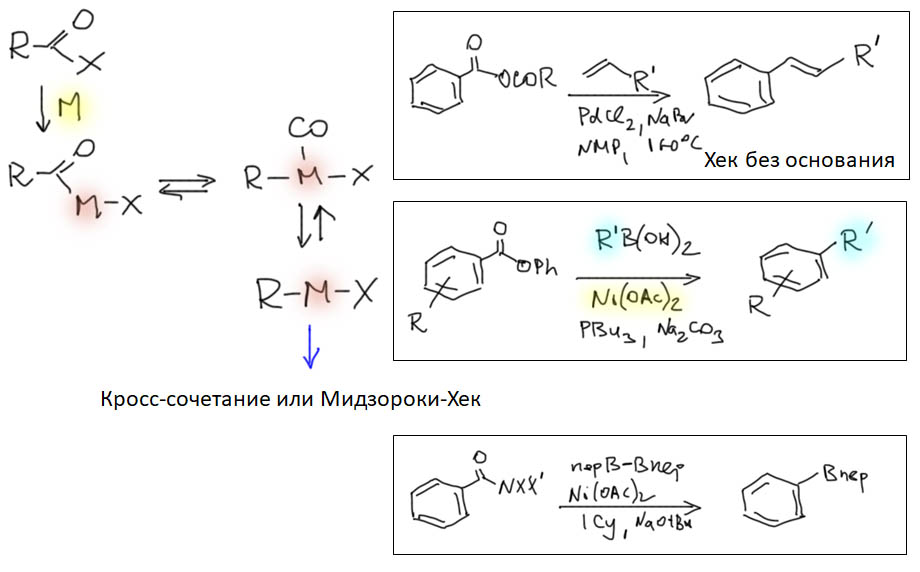
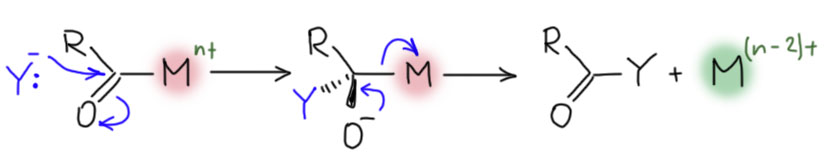
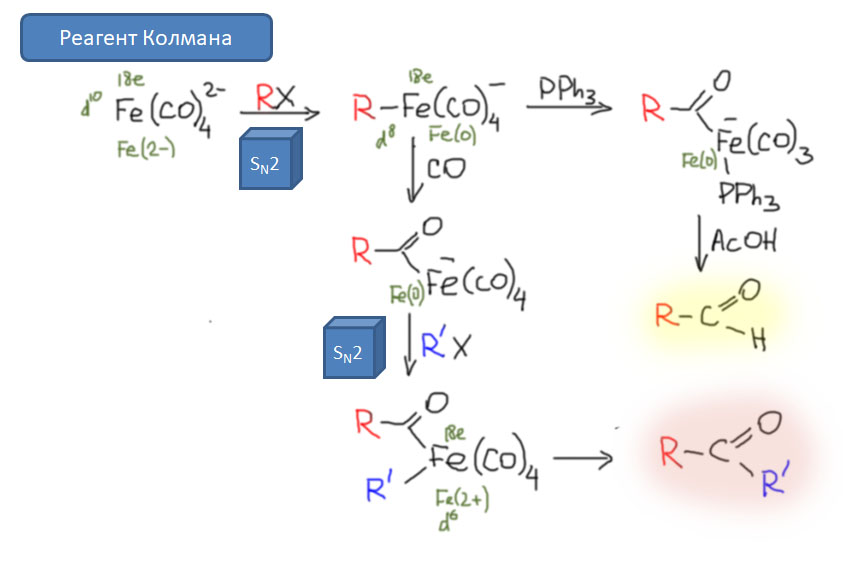
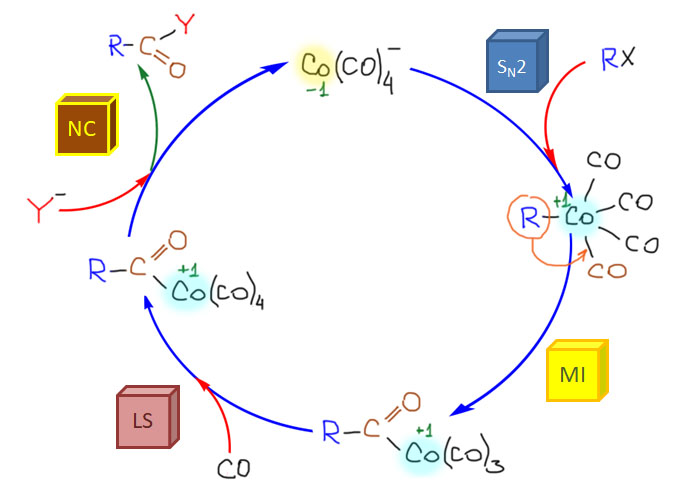
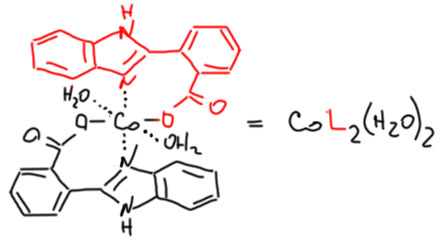
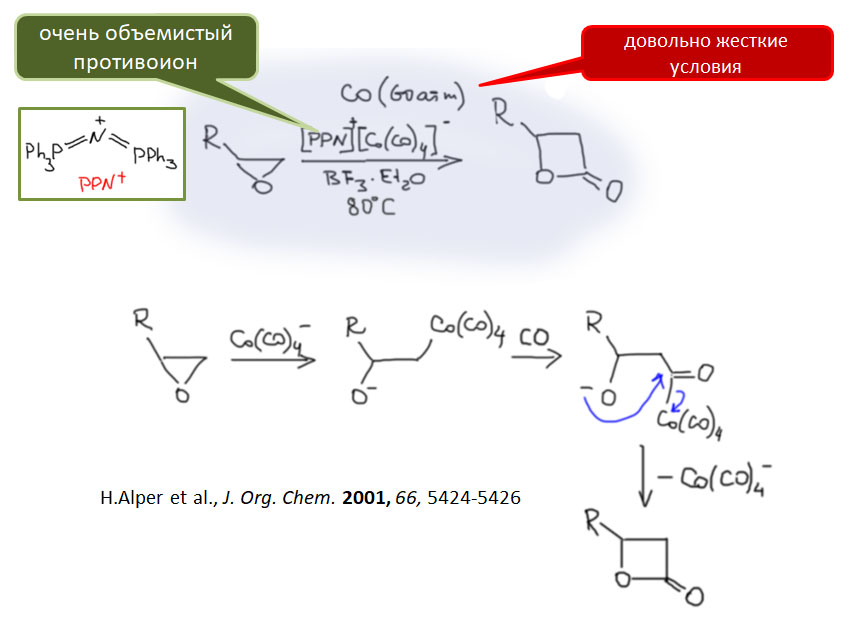
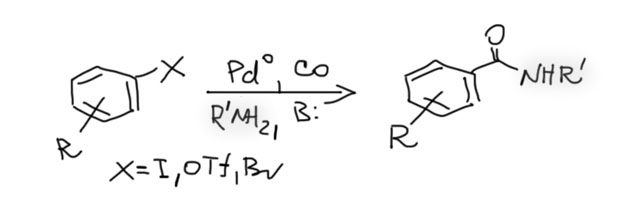
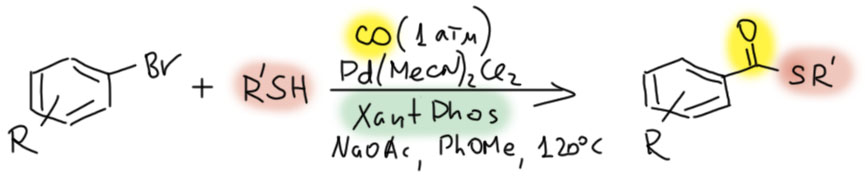
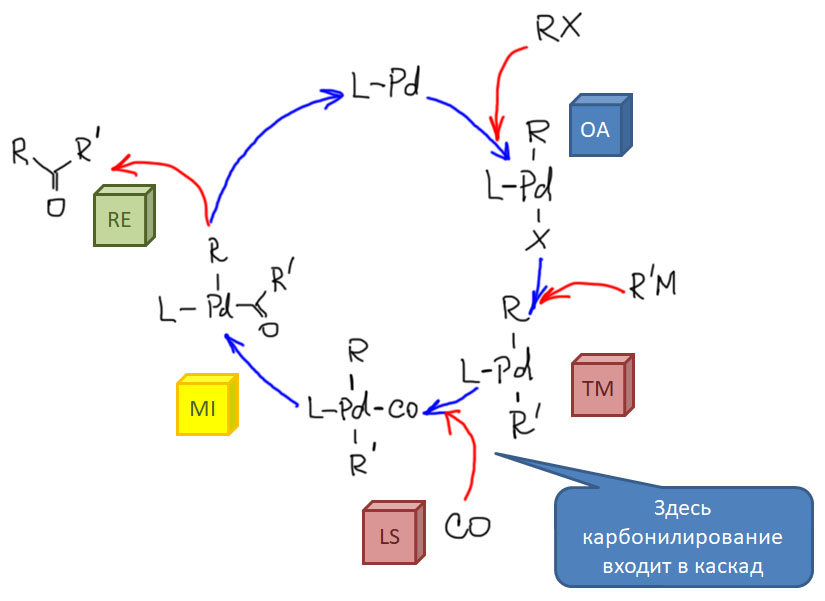
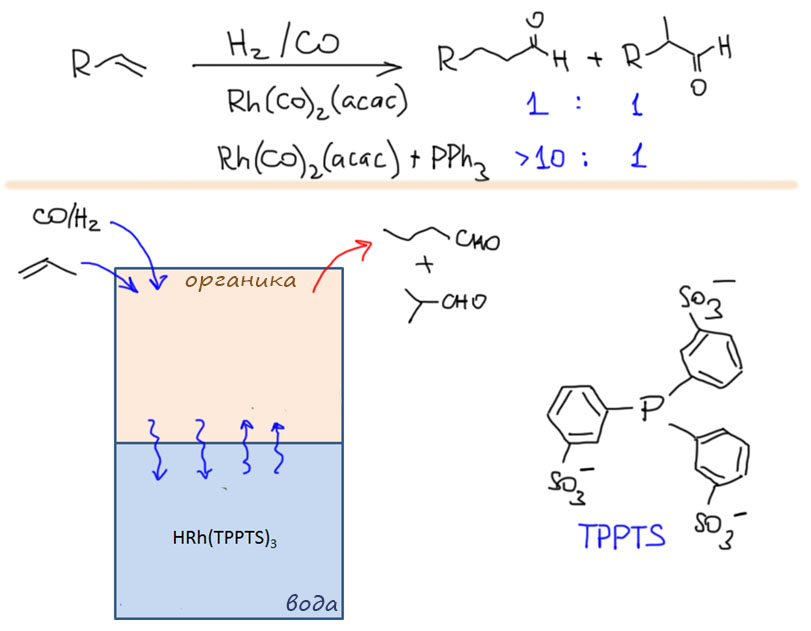
Теперь обратим наше внимание на применение карбонилов и оксида углерода в синтезе. Начнем с очень симпатичной химии, ключевую роль в которой играют высоконуклеофильные карбонилаты металлов. Эта химия использует супернуклеофильность анионных карбонилов, которые очень охотно вступают в SN2-замещение с типичными для этой реакции субстратами. Эта химия начиналась со стехиометрических реакций карбонилатов железа, но развитие получила в каталитических реакциях с участием легкодоступного карбонилата кобальта. Именно с исследования этой химии начал свой невероятный путь в химии – от Нобеля к нобелю – Ричард Хек. Хотя эти реакции ограничены высокореакционноспособными субстратами, пригодными для SN2-замещения, то есть, в основном, с бензилгалогенидами и некоторыми другими соединениями, но в ряде случаев эта химия эффективна и полезна.
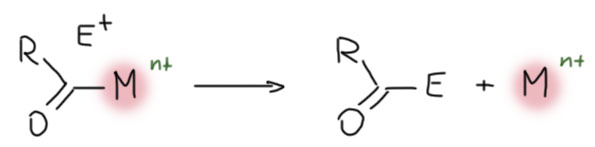
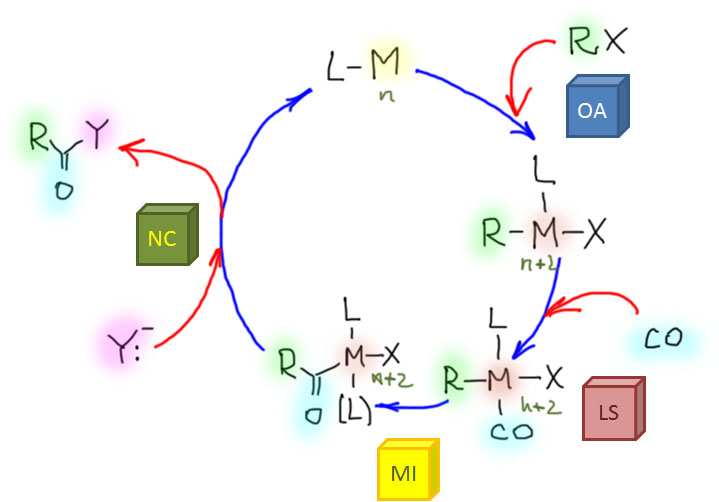
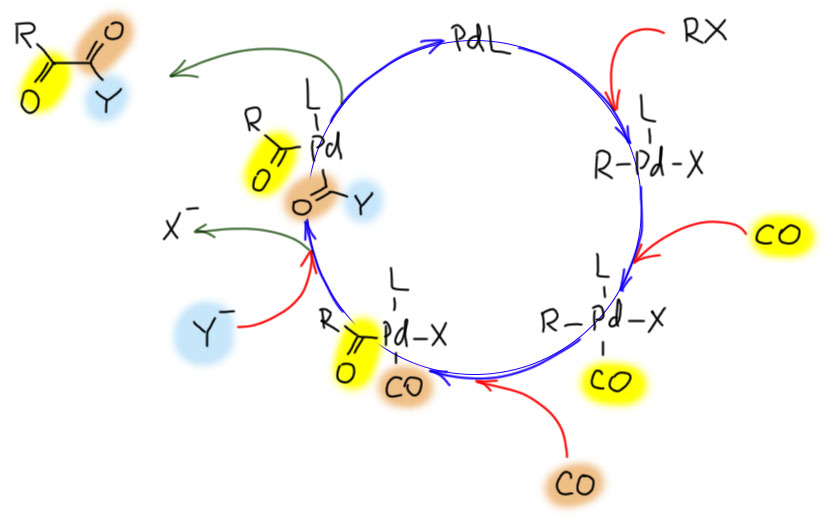
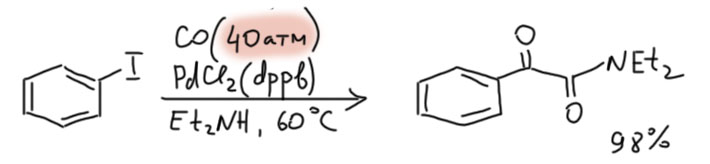
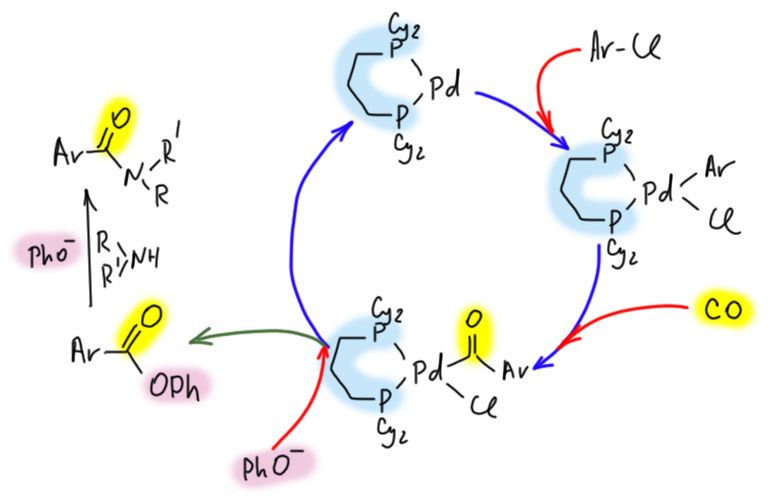
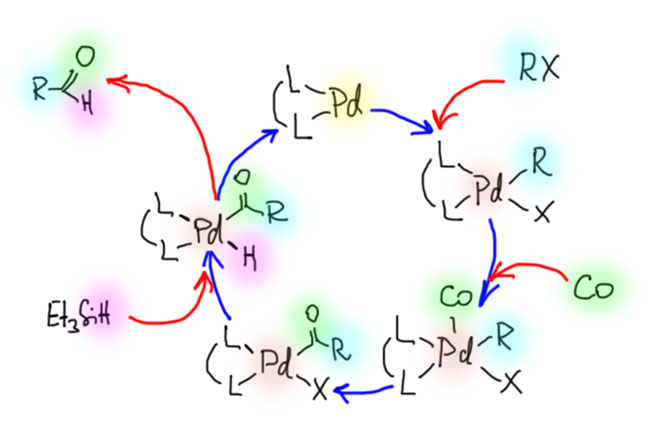
Но гораздо более мощные методы используют не нуклеофильное замещение, а окислительно присоединение, и здесь на авансцену выходят хорошо нам знакомые металлы 10 группы – никель и палладий, а также два благородных родственника кобальта родий и иридий.
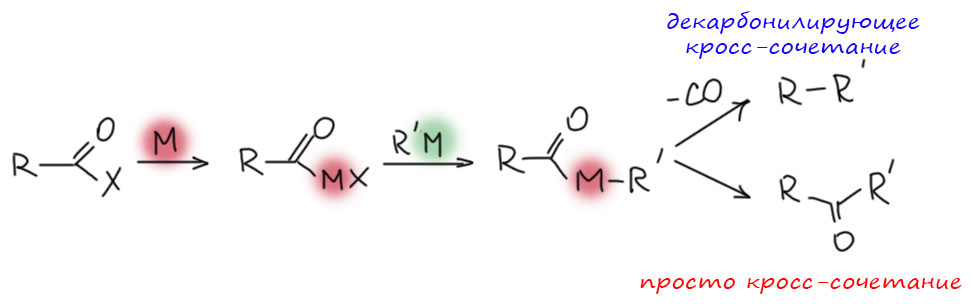
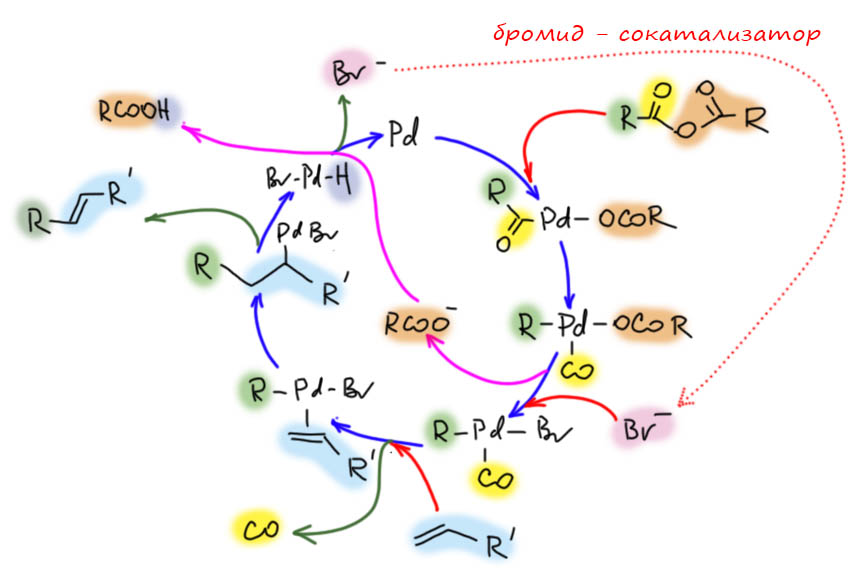
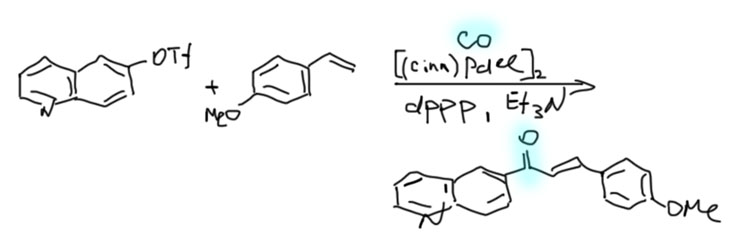
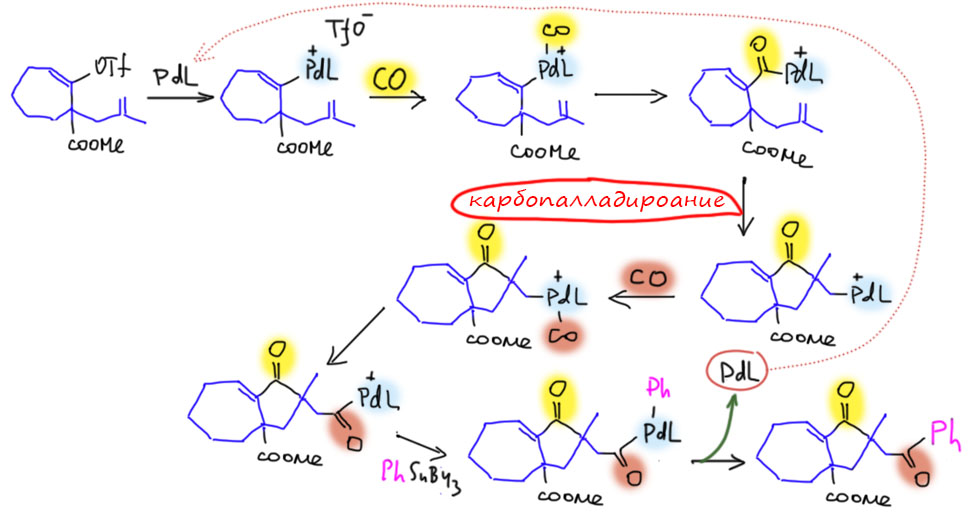
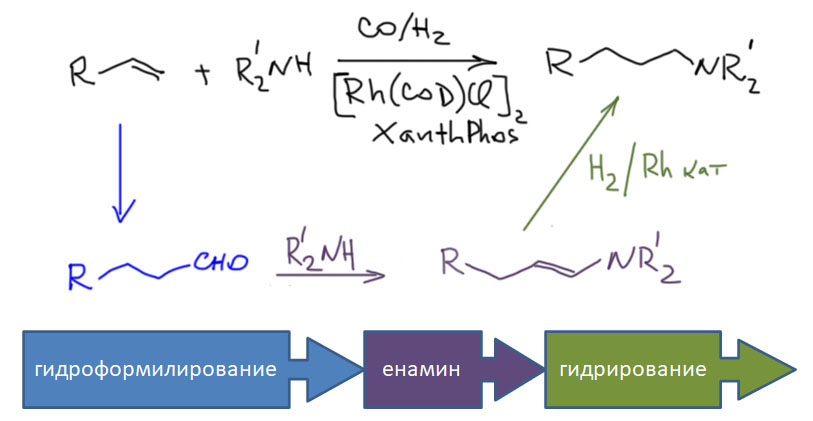
От простого карбонилирования несложно перейти к более сложным процессам – карбонилирующим каскадам. Стадии миграционного внедрения карбонила часто встречаются в более сложных превращениях. включающих стадии кросс-сочетания, карбопалладирования, восстановительного элиминирования. Сложность получающихся продуктов ограничена только фантазией синтетика.
А теперь займёмся очень сложной химией, в которой карбонилирование сочетается с реакциями двойных и тройных связей. Здесь много важнейших промышленных реакций, ещё больше трудноразрешимых проблем, и как минимум, одна, но чрезвычайно популярная в тонком органическом синтезе реакция Посона-Кханда. И здесь уже мало палладия, и много металлов 9 группы кобальта и родия.
Диоксид углерода в смысле доступности и опасности отличается от CO радикально. Колоссальные количества этого вещества находятся в атмосфере и ежесекундно вырабатываются при сжигании топлива и жизнедеятельности живых организмов. Проблема глобального потепления как раз и связана с значительным повышением концентрации диоксида углерода в атмосфере по причине деятельности человека. Любители спорить с этим как-то совершенно не учитывают тот очевидный факт, что человечество за сто с небольшим лет достало из недр земли и вернуло в атмосферу то, что в этих недрах накапливалось миллионами лет, уходя как раз из атмосферы за счёт фотосинтеза и захоронения растительных остатков на больших глубинах. Тут как раз неплохо бы не доказывать, почему в атмосфере так сильно возрос уровень углекислоты, а желающим это опровергнуть – попробовать объяснить, куда подевался такой чудовищный объём возвращённого в атмосферу углекислого газа, и как может такое быть, что такое кратковременное изменение состава атмосферы вообще не имеет последствий. А объём действительно чудовищный, ведь львиная доля потребностей всего человечества в энергии была покрыта за счёт сжигания ископаемого топлива.
Многим приходит в голову идея, что углекислый газ нужно из атмосферы забирать. А куда девать? Самое надёжное было бы отправить обратно в глубины земли. Но как это сделать совершенно непонятно. И поскольку человек – существо недальновидное, но промысловатое, рождаются идеи как бы не просто углекислый газ из атмосферы забирать, но ещё что-то полезное из этого делать, что можно хорошо продать и тем самым покрыть расходы на это производство, да еще и наварить немного. Получить пока из CO2 ничего особенного не удалось, но саму эту идею удалось хорошо продать политикам разных стран и чиновникам международных организаций так, что исследования в этой области в последние 10 лет стали финансировать не просто щедро, а прямо баснословно щедро. В научных журналах последних 10 лет просто глаза рябит от статей про новые реакции из CO2, и в начале почти каждой такой статьи будет обязательно написано про благородную цель избавить человечество от медленного поджаривания и одновременное получение ценнейших материалов, лекарств, полимеров, и т.п. Большинство таких исследований производят совершенно комическое впечатление. Что-то полезное в них подчас действительно получается, но авторы умудряются не замечать двух вещей: мизерных потребностей человечества в предлагаемых продуктах и огромных затрат материалов и энергии на осуществление предлагаемой реакции. Проблема в том, что CO2 из атмосферы нужно убирать в масштабах десятков гигатонн, а всё производство органической продукции химической промышленности оценивается величинами в сто раз меньшими. Поэтому даже в совершенно фантастическом варианте, когда вообще все органические материалы будут получать из CO2, количество забранного из атмосферы на эти цели диоксида углерода было бы пренебрежимо мало и на баланс углерода серьёзного влияния бы не оказало. Точность современных оценок этого баланса гораздо больше, чем эти количества, и титанических усилий планета наша просто не заметила бы. Но, увы, это ещё не всё. На любой химический процесс тратится очень много энергии и материалов. В расчётах все такие затраты пересчитывают на затраченную энергию, и делают простую оценку, сколько CO2 при этом будет выброшено обратно в атмосферу – это называется “углеродным следом” продукции или процесса. Проблема ведь в том, что энергию до сих пор в основном получают сжиганием ископаемого топлива. Можно просто взять энергетические и топливные балансы крупных стран, чтобы в этом убедиться. Да, когда-нибудь энергию будут получать целиком из возобновляемых источников с нулевым углеродным следом. Но тогда и выброс CO2 в атмосферу уменьшится действительно радикально, планета придёт к новому балансу, и смысла забирать из атмосферы углекислоту не будет.
Очень забавный пример уровня таких рассуждений – часто приводимый пример того, что диоксид углерода уже используется в больших масштабах в промышленности – производство карбамида, то есть мочевины из аммиака и углекислого газа. Это действительно очень крупномасштабный процесс. И мочевина совершенно официально считается органическим соединением, и даже более того – первым органическим соединением, полученным синтезом из более простых, официально неорганических соединений. Считается, что именно с этой реакции, реакции Вёлера, идёт вся органическая химия как наука. Это всё очень трогательно, если забыть, для чего используется получаемая таким образом мочевина. Но – это удобрение, азотное удобрение, очень хорошее. И первое, что с ним происходит, когда оно попадает в почву – расщепление микроорганизмами на ион аммония и – диоксид углерода. Это Бог дал – Бог и взял. А у нас всё наоборот – углекислый газ взяли – углекислый газ и отдали. Ну, хоть растения растут, но CO2 вернулся в атмосферу. На самом деле даже в гораздо больших количествах, чем взяли, потому что аммиак, необходимый для этой реакции, образуется очень энергозатратным синтезом Габера-Боша, имеющим очень большой углеродный след.
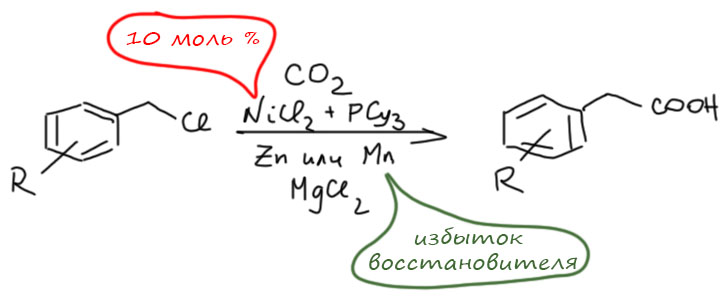
Всё это безусловно не значит, что заниматься химией CO2 не стоит. Химией вообще заниматься стоит, но именно с целью получения полезных материалов и веществ. Если будет хороший процесс с использованием углекислоты – очень хорошо. Пока с этим не очень хорошо, но нас должна вдохновлять Природа, которая очень хорошо справляется с CO2 – для неё это основной источник углерода (carbon feedstock) для синтеза всех органических соединений, и это не только фотосинтез, но и довольно многочисленные реакции ферментативного карбоксилирования.