Открыта охота за плюсиками
Зачеты просто так не раздают. Зачеты раздают за плюсики. Так как плюсики есть не у всех, объявляется охота за плюсиками в виде совершенно головоломного квеста, в котором каждый сможет проявить себя выдающимся знатоком органического синтеза с помощью комплексов переходных металлов.
Квест будет организован таким образом.
Прежде всего, не отменяется охота за опечатками и ошибками на сайте. Вы уже много исправили, и я очень благодарен за это, но уверен, что число опечаток пока еще велико. Таков закон – чем больше ошибок исправлено, тем больше их осталось. Ищите и присылайте исправления. К тому же, объявляется конкурс на поиск самой дурацкой ошибки или опечатки. Таковая будет сразу оценена 5 плюсами. Присылайте кандидатов, я сам выберу самую дурацкую, но остальные все равно будут оценены, но пожиже.
Но основной квест гораздо более крутой.
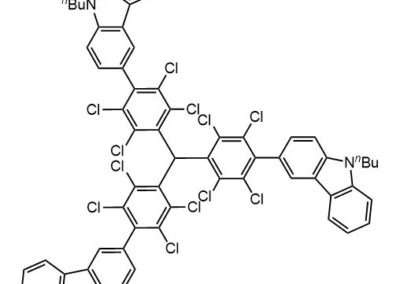
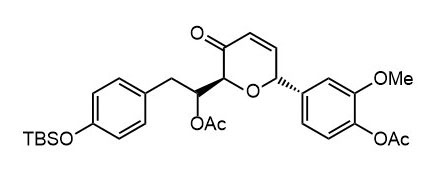
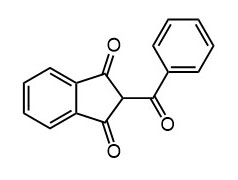
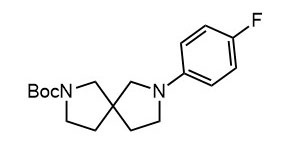
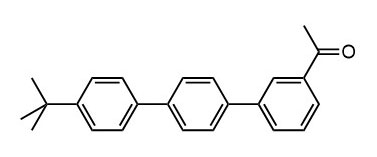
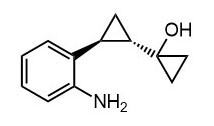
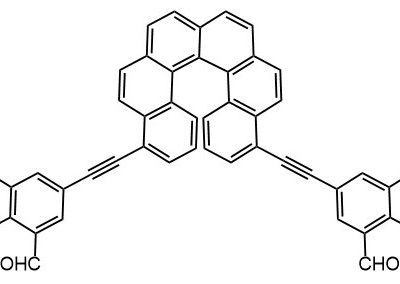
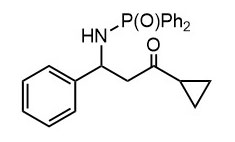
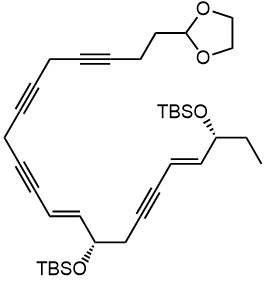
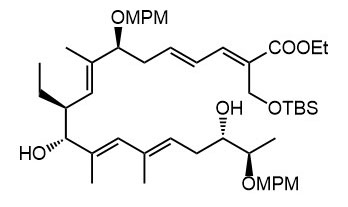
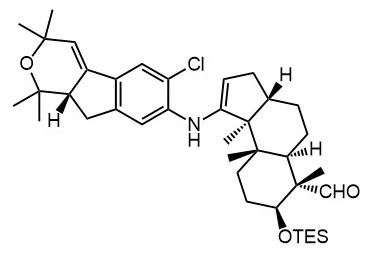
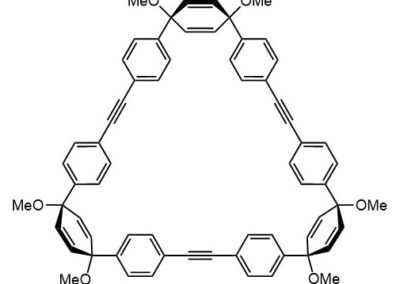
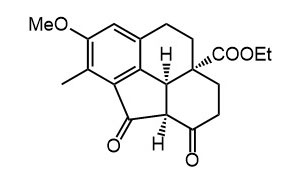
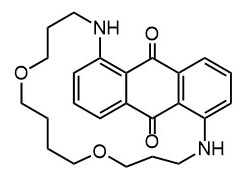
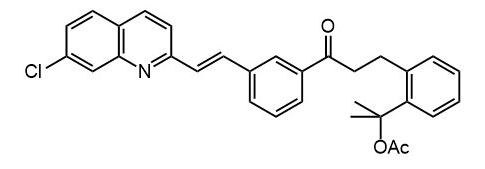
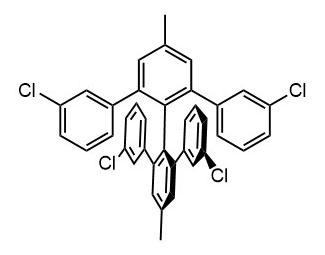
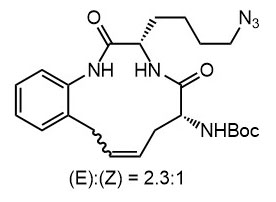
Ниже нарисованы 20 структур, взятые непосредственно из научных статей за несколько последних лет. Эти структуры получены в результате использования реакций с участием комплексов переходных металлов. В каждой из статей описаны многостадийные синтезы, с множеством разных реакций и методов, но имеется в виду, что каждая из показанных структур образовалась непосредственно с помощью одной из таких реакций – к структуре идет стрелочка с одной из таких реакций (еще раз – реакции, использованные в синтезах раньше или позже не имеют значения):
- реакции Мидзороки-Хека и каскадов на ее основе (MH);
- карбонилирования и каскадов на его основе (CO);
- C-C кросс-сочетания по Судзуки-Мияуре с бороорганическими соединениями (SM);
- C-C кросс-сочетания по Негиси с цинк-органическими соединениями (NZn);
- C-C кросс-сочетания по Стилле с олово-органическими соединениями (SnS);
- C-C кросс-сочетания по Соногасире с терминальными ацетиленами (Son);
- реакции Кулинковича (TiK);
- реакции нуклеометаллирования (NuAu);
- C-N кросс-сочетания по Бачуолду-Хартвигу (BH);
- метатезиса олефинов (MO);
- метатезиса алкинов (MA).
Первый этап квеста – до полуночи 10 мая. С 11 мая не принимается.
Напишите список, в котором сопоставьте каждую из структур с одной из перечисленных реакций – типа, угадайте. Используйте короткую запись – индекс структуры (буква под структурой) – условное обозначение реакции (в скобках в конце каждой реакции в списке выше. Смысл простой – просто посмотрите на структуру, и подумайте, что в ней могло быть устроено с помощью одной из реакций списка. Пока не смотрите статьи, успеете. Это игра такая – на визуальное восприятие. Если все 20 сопоставлений будут верны, а это совершенно невероятный вариант, получите 5 плюсов (поскольку этот вариант невероятен, то не получите). Если меньше, то кратно меньше (один плюс за четыре угаданных, с округлением). В этом этапе участвовать не обязательно. В следующем тоже, но плюсики как-то добывать надо.
Второй этап квеста
Ищите каждую из структур (любые, на ваш выбор) в статьях из списка под структурами. Это не очень легко, все структуры перерисованы и не вполне зрительно соответствуют графике из статей, а в некоторых статьях вообще много сложных структур, а порядок структур не соответствует порядку статей в списке. Но мы тут взялись играть в кубики и Очень Полезный Горшок по-серьезному, и не должны пугаться испытаний реальной современной научной литературой на родном языке великого хозяина Горшка. Ищите и обрящете. Никто не просит прочитать их все, возможно, хватит и одной-двух. К тому же меня совершенно не волнует, самостоятельно вы будете это делать или коллективно. Некоторые из вас хотят научиться химии, и с ними проблем никаких нет. Некоторые хотят чего-то другого, и с ними проблем и быть не может. Следовательно, проблем вообще не бывает, если их не выдумывать. Все будет хорошо, в полном соответствии с Программной Речью.
Про каждую из выбранных вами и найденных в статье структур напишите
а) использованный метод;
б) использованный катализатор (пред-катализатор);
в) основной лиганд, в том случае, если в состав катализатора входит какой-либо специальный лиганд, а если нет, то так и напишите – каталитическая система не требует специальных лигандов;
г) прикиньте величины TON и TOF там, где это возможно, а там, где это невозможно, тоже так и напишите – нет данных для оценки TON/TOF. За все четыре правильных ответа к одной структуре получите 4 плюса. Когда оцениваете величину TOF, не нужно все переводить в единицы СИ – просто используйте то время, которое есть в эксперименте. Час так час, день так день, да хоть год. Каталитические реакции с оборачиваемостью в масштабе секунд очень редки, а величины, измеряемые десятью в минус какой-то степени, нормальных органиков сильно травмируют.
Ответы и предложения пересылайте на почту любым способом – напишите на бумажке, сфотографируйте мобилой, или еще как-то, не важно. Или напишите на бумажке и закиньте в к. 215.
Главный вопрос – сколько плюсов нужно для зачета. Не знаю. Как же быть? Очень просто. Поглядывайте в текущий рейтинг. Он будет обновляться с разумной скоростью. Не гонитесь за чемпионами рейтинга – с ними и так все ясно. Но обязательно насторожитесь, если увидите, что у вас меньше всех, а таких как вы очень мало. Тогда срочно нужно добавить, пусть другие волнуются.
Откуда брать статьи. Во-первых, на факультете есть подписка на основные научные издательства и издаваемые ими журналы. Если вы заходите на сайты издательств с компьютеров, расположенных на факультете, то к большинству указанных статей доступ есть. Просто вбивайте универсальный индекс статьи (это называется DOI и указано в конце каждой из ссылок) прямо в гугл и открывайте ссылку. Во-вторых, с любого компьютера можно использовать весьма популярный сайт sci-hub.tw, вбивая туда тоже DOI. Никаких этических границ вы при этом не перейдете – вы имеете право на доступ к статьям из важнейших научных журналов, предоставляемый вам подпиской через ваш Университет. Но вы не виноваты в том, что упомянутый университет забыл или не захотел предоставить вам удобный доступ к этой подписке, например, в виде возможности пользоваться официальным прокси-сервером, как это устроено в большинстве других университетов.
Вперед!
Литература
- Bollikonda, S., S. Mohanarangam, R. R. Jinna, V. K. K. Kandirelli, L. Makthala, S. Sen, D. A. Chaplin, R. C. Lloyd, T. Mahoney, V. H. Dahanukar, S. Oruganti and M. E. Fox (2015). “An Enantioselective Formal Synthesis of Montelukast Sodium.” The Journal of Organic Chemistry 80(8): 3891-3901 DOI: 10.1021/acs.joc.5b00197.
- Dumslaff, B., A. N. Reuss, M. Wagner, X. L. Feng, A. Narita, G. Fytas and K. Mullen (2017). “Covalently Interlocked Cyclohexa-m-phenylenes and Their Assembly: En Route to Supramolecular 3D Carbon Nanostructures.” Angewandte Chemie-International Edition 56(35): 10602-10606 DOI: 10.1002/anie.201705403.
- Goto, T., D. Urabe, K. Masuda, Y. Isobe, M. Arita and M. Inoue (2015). “Total Synthesis of Four Stereoisomers of (4Z,7Z,10Z,12E,16Z,18E)-14,20-Dihydroxy-4,7,10,12,16,18-docosahexaenoic Acid and Their Anti-inflammatory Activities.” The Journal of Organic Chemistry 80(15): 7713-7726 DOI: 10.1021/acs.joc.5b01461.
- Gu, X., T. Y. Gopalakrishna, H. Phan, Y. Ni, T. S. Herng, J. Ding and J. S. Wu (2017). “A Three-Dimensionally -Conjugated Diradical Molecular Cage.” Angewandte Chemie-International Edition 56(48): 15383-15387 DOI: 10.1002/anie.201709537.
- Jeanne-Julien, L., G. Masson, E. Astier, G. Genta-Jouve, V. Servajean, J. M. Beau, S. Norsikian and E. Roulland (2017). “Synthesis of a Tiacumicin B Protected Aglycone.” Organic Letters 19(15): 4006-4009 DOI: 10.1021/acs.orglett.7b01744.
- Lee, S., E. Chenard, D. L. Gray and J. S. Moore (2016). “Synthesis of Cycloparaphenyleneacetylene via Alkyne Metathesis: C-70 Complexation and Copper-Free Triple Click Reaction.” Journal of the American Chemical Society 138(42): 13814-13817 DOI: 10.1021/jacs.6b08752.
- Li, Z. and R. Tong (2017). “Asymmetric Total Syntheses of (−)-Hedycoropyrans A and B.” The Journal of Organic Chemistry 82(2): 1127-1135 DOI: 10.1021/acs.joc.6b02738.
- Liu, Q., P. Hu and Y. He (2017). “Asymmetric Total Synthesis of Nannocystin A.” The Journal of Organic Chemistry 82(17): 9217-9222 DOI: 10.1021/acs.joc.7b01502.
- Malik, A. U., F. W. Gan, C. S. Shen, N. Yu, R. B. Wang, J. Crassous, M. H. Shu and H. B. Qiu (2018). “Chiral Organic Cages with a Triple-Stranded Helical Structure Derived from Helicene.” Journal of the American Chemical Society 140(8): 2769-2772 DOI: 10.1021/jacs.7b13512.
- Qiu, D., S. Wang, S. Tang, H. Meng, L. Jin, F. Mo, Y. Zhang and J. Wang (2014). “Synthesis of Trimethylstannyl Arylboronate Compounds by Sandmeyer-Type Transformations and Their Applications in Chemoselective Cross-Coupling Reactions.” The Journal of Organic Chemistry 79(5): 1979-1988 DOI: 10.1021/jo402618r.
- Ranyuk, E. R., A. D. Averin and I. P. Beletskaya (2010). “One‐Step Synthesis of Chiral Azamacrocycles via Palladium‐Catalyzed Enantioselective Amination of 1,5‐Dichloroanthraquinone and 1,5‐Dichloroanthracene.” Advanced Synthesis & Catalysis 352(13): 2299-2305 DOI: 10.1002/adsc.201000181.
- Reilly, S. W., N. W. Bryan and R. H. Mach (2017). “Pd-catalyzed arylation of linear and angular spirodiamine salts under aerobic conditions.” Tetrahedron Letters 58(5): 466-469 DOI: 10.1016/j.tetlet.2016.12.063.
- Sánchez, D., T. Andreou, A. M. Costa, K. G. Meyer, D. R. Williams, I. Barasoain, J. F. Díaz, D. Lucena-Agell and J. Vilarrasa (2015). “Total Synthesis of Amphidinolide K, a Macrolide That Stabilizes F-Actin.” The Journal of Organic Chemistry 80(17): 8511-8519 DOI: 10.1021/acs.joc.5b00966.
- Tai, S., E. J. Dover, S. V. Marchi and J. D. Carrick (2015). “Pd-Catalyzed Diamination of 1,2,4-Triazinyl Complexant Scaffolds.” The Journal of Organic Chemistry 80(12): 6275-6282 DOI: 10.1021/acs.joc.5b00710.
- Tyagi, S., C. D. Cook, D. A. DiDonato, J. A. Key, B. P. McKillican, W. J. Eberle, T. J. Carlin, D. A. Hunt, S. J. Marshall and N. L. Bow (2015). “Bioinspired Synthesis of a Sedaxane Metabolite Using Catalytic Vanadyl Acetylacetonate and Molecular Oxygen.” The Journal of Organic Chemistry 80(24): 11941-11947 DOI: 10.1021/acs.joc.5b01700.
- Xu, L., C. Wang, Z. Gao and Y.-M. Zhao (2018). “Total Synthesis of (±)-Cephanolides B and C via a Palladium-Catalyzed Cascade Cyclization and Late-Stage sp3 C–H Bond Oxidation.” Journal of the American Chemical Society 140(16): 5653-5658 DOI: 10.1021/jacs.8b03015.
- Yang, X., L. P. Beroske, J. Kemmink, D. T. S. Rijkers and R. M. J. Liskamp (2017). “Synthesis of bicyclic tripeptides inspired by the ABC-ring system of vancomycin through ruthenium-based cyclization chemistries.” Tetrahedron Letters 58(48): 4542-4546 DOI: 10.1016/j.tetlet.2017.10.046.
- Ying, J. and L. Pu (2016). “Regiospecific Hydration of N-(Diphenylphosphinoyl)propargyl Amines: Synthesis of β-Amino Ketones by Au(III) Catalysis.” The Journal of Organic Chemistry 81(18): 8135-8141 DOI: 10.1021/acs.joc.6b01111.
- Zhang, Y., J.-L. Chen, Z.-B. Chen, Y.-M. Zhu and S.-J. Ji (2015). “Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-dione Derivatives.” The Journal of Organic Chemistry 80(21): 10643-10650 DOI: 10.1021/acs.joc.5b01758.
- Zou, Y. and A. B. Smith (2018). “Total synthesis of architecturally complex indole terpenoids: strategic and tactical evolution.” Journal of Antibiotics 71(2): 185-204 DOI: 10.1038/ja.2017.94.