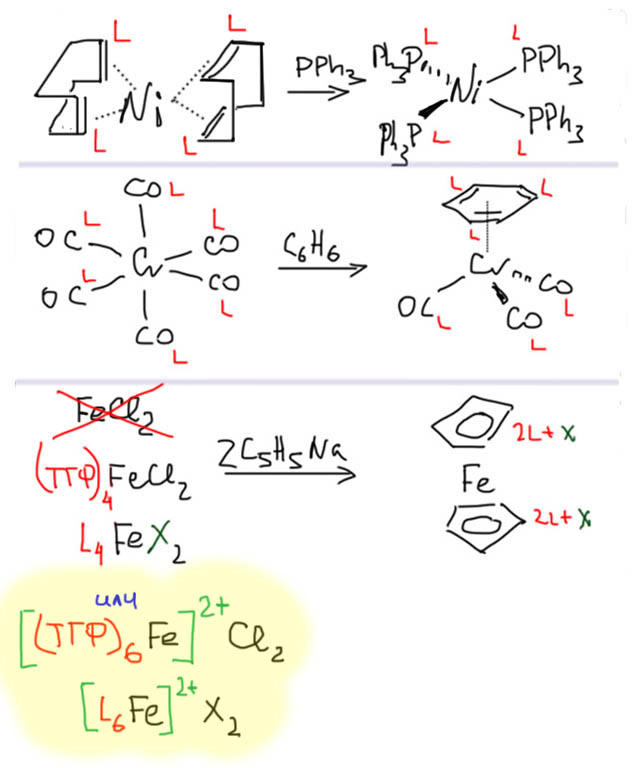
Замещение лигандов
Реакции координационных соединений всегда происходят в координационной сфере металла со связанными в ней лигандами. Поэтому очевидно, что для того, чтобы вообще что-то происходило, лиганды должны уметь в эту сферу попадать. Это может происходить двумя способами:
- координационно-ненасыщенный комплекс связывает новый лиганд
- в уже укомплектованной координационной сфере один лиганд меняется на другой.
С первым способом мы уже ознакомились, когда обсуждали координационную ненасыщенность и 18-электронное правило. Вторым займемся здесь.
Замещаться могут в любых комбинациях лиганды любых типов
Но обычно действует негласное правило – количество занятых координационных мест не изменяется. Иными словами, при замещении не меняется счет электронов. Замещение лиганда одного типа на другой вполне возможно и часто происходит в реальности. Обратим только внимание на корректное обращение с зарядами, когда меняется L-лиганд на X-лиганд и наоборот. Если мы про это забудем, то изменится степень окисления металла, а замещение лигандов не является окислительно-восстановительным процессом (если найдете или придумаете противный пример, дайте знать – зачет автоматом сразу, если я не смогу доказать, что вы ошиблись, впрочем даже и в этом случае гарантирую положительный вклад в карму) .

Замещение с участием гапто-лигандов
С более сложными лигандами сложностей не больше – нужно просто помнить довольно очевидное правило: количество лигандных мест (то есть общее количество лигандов или лигандных центров X- или L-типов) сохраняется. Это непосредственно следует из сохранения счета электронов. Вот самоочевидные примеры.
Обратим внимание на последний пример. Исходный реагент для этой реакции дихлорид железа FeCl2. Еще недавно мы бы сказали: “Это просто соль, причем тут координационная химия?”. Но больше мы не будем себе позволять такое невежество. В химии переходных металлов не бывает “просто солей”, любые производные суть координационные соединения, к которым применимы все рассуждения про счет электронов, d-конфигурацию, координационную насыщенность и т.п. Дихлорид железа, так как мы его привыкли писать, оказался бы комплексом Fe(2+) типа MX2 с конфигурацией d6 и числом электронов 10. Маловато что-то! Нормально? Ведь мы уже разобрались, что лиганды бывают неявные. Чтобы сделать реакцию, нам нужен растворитель, и для таких реакций это, скорее всего, ТГФ. Растворение кристаллической соли железа в ТГФ и происходит именно потому, что донорный растворитель занимает свободные места, и энергия этого процесса компенсирует разрушение кристаллической решетки. Мы не смогли бы растворить эту “соль” в растворителе, не предоставляющем услуг сольватации металла за счет основности Льюиса. В данном случае, и в миллионе подобных, сольватация это просто координационное взаимодействие. Напишем, просто для определенности результат сольватации в виде комплекса FeX2L4, у которого два иона хлора остаются в координационной сфере в виде двух X-лигандов, хотя скорее всего они тоже вытеснены молекулами донорного растворителя с образованием заряженного комплекса FeL62+. В данном случае это не так важно. И так, и эдак мы можем спокойно считать, что у нас 18-электронный комплекс и слева, и справа.
Замещение, присоединение и диссоциация лигандов тесно и неразрывно связаны
Если мы помним органическую химию, то там было два механизма замещения при насыщенном атоме углерода – SN1 и SN2. В первом замещение происходило двухстадийно: старый заместитель сначала уходил, оставляя вакантную орбиталь на атоме углерода, на которую следом заходил новый заместитель с парой электронов. Второй механизм предполагал, что уход и приход осуществляются одновременно, согласованно, а процесс был одностадийным.
В химии координационных соединений вполне можно представить нечто похожее. Но появляется и третья возможность, которой не было у насыщенного атома углерода – сначала присоединяем новый лиганд, потом отцепляем старый. Сразу становится понятно, что этот третий вариант вряд ли возможен, если комплекс уже имеет 18 электронов и является координационно насыщенным. Но вполне возможен, если число электронов 16 или меньше, то есть комплекс ненасыщен. Тут же вспомним и очевидную аналогию из органической химии – нуклеофильное замещение у ненасыщенного атома углерода (в ароматическом кольце или у карбонильного углерода) тоже идут сначала как присоединение нового нуклеофила, и потом отщепление старого.
Итак, если у нас 18 электронов, то замещение идет как отщепление-присоединение (любители “умных” словечек используют термин диссоциативно-ассоциативный или просто диссоциативный механизм). Другой путь потребовал бы расширения координационной сферы до счета в 20 электронов. Это не является абсолютно невозможным, и такие варианты иногда даже рассматриваются, но это точно очень невыгодно и каждый раз в случае подозрения на такой путь требуются очень весомые доказательства. В большинстве таких историй исследователи в конце концов приходили к выводу, что они что-то просмотрели или не учли, и ассоциативный механизм отвергался. Итак, если исходный комплекс с 18 электронами, то сначала один лиганд должен уйти, затем на его место прийти новый, например:

Если мы хотим ввести в координационную сферу гапто-лиганд, занимающий несколько мест, то сначала мы должны их все освободить. Как правило, это происходит только в достаточно жестких условиях, например, чтобы в карбониле хрома заменить три карбонила на η6-бензол, смесь много часов нагревают под давлением, время от времени стравливая высвободившийся оксид углерода. Хотя в схеме нарисована диссоциация трех лигандов с образованием очень ненасыщенного комплекса с 12 электронами, в реальности реакция, скорее всего происходит стадийно, уходит по одному карбонилу, а бензол заходит в сферу, постепенно увеличивая гаптность, через стадии минус CO – дигапто – минус еще одна CO – тетрагапто – минус еще одна CO – гексагапто, так чтобы меньше 16 электронов не получалось.

Итак, если у нас комплекс с 16 электронами или меньше, то замещение лиганда, скорее всего, идет как присоединение-отщепление (для любителей глубокомысленных слов: ассоциативно-диссоциативный или просто ассоциативный): новый лиганд сначала приходит, затем старый уходит. Напрашиваются два очевидных вопроса: почему уходит старый лиганд, ведь 18 электронов это очень хорошо, и почему бы и в этом случает не сделать наоборот, как в 18-электронных комплексах. На первый вопрос ответить легко: у каждого металла свои привычки, и некоторые металлы, особенно из поздних, с почти полностью заполненными d-оболочками, предпочитают 16-электронный счет и соответствующие структурные типы, поэтому и выбрасывают лишний лиганд, возвращаясь к любимой конфигурации. Иногда в дело еще вмешивается пространственный фактор, уже имеющиеся лиганды большие и дополнительный чувствует себя, как пассажир автобуса в час пик. Проще сойти и прогуляться пешком, чем так мучиться. Впрочем, можно выпихнуть другого пассажира, пусть погуляет, а мы поедем. Второй вопрос тоже прост – в этом случае диссоциативный механизм должен был бы сначала дать 14-электронный комплекс, а это редко бывает выгодно.
Вот пример. Для разнообразия заменим X-лиганд на L-лиганд, и не запутаемся в степенях окисления и зарядах. Еще раз: при замещении степень окисления не меняется, и если ушел X-лиганд, то потерю нужно скомпенсировать зарядом на металле. Если про это забыть, то степень окисления уменьшилась бы на 1, а это неверно.

И еще одна странность. Образовалась связь металл-пиридин за счет неподеленной пары на азоте. В органической химии в этом случае мы обязательно показали бы плюс на азоте пиридина (например, при протонировании или образовании четвертичной соли), но мы никогда не делаем это в координационной химии ни с пиридином, ни с любыми другими L-лигандами. Это страшно раздражает всех, кто привык к строгой и недвусмысленной системе рисования структур в органической химии, но придется привыкать, это не так сложно.
А точного аналога SN2 в химии координационных соединений нет, есть далекий, но он относительно редок и нам не очень нужен.
Стабильные и лабильные лиганды
Про механизмы замещения лигандов можно было бы вообще не говорить, если бы не одно чрезвычайно важное обстоятельство, которым мы будем очень много пользоваться: замещение лигандов, хоть ассоциативное, хоть диссоциативное обязательно предполагает диссоциацию старого лиганда. И нам очень важно знать, какие лиганды легко уходят, а какие уходят плохо, предпочитая оставаться в координационной сфере металла.
Как мы скоро увидим, в любой реакции часть лигандов остается в координационной сфере и не изменяется. Такие лиганды принято называть лигандами-зрителями (если не хотите таких простых, “ненаучных” слов, используйте английское слово spectator в местной транскрипции спектатор, лиганд-спектатор, только, умоляю, не спектейтор – это невыносимо!). А часть непосредственно участвует в реакции, превращаясь в продукты реакции. Такие лиганды называют акторами (не актерами!), то есть действующими. Вполне понятно, что лиганды-акторы нужно в координационную сферу металла легко вводить и выводить, иначе реакция просто застрянет. А вот лиганды-спектаторы лучше в координационной сфере оставлять по многим причинам, но хотя бы и по такой банальной как необходимость избежать излишней суеты вокруг металла. Лучше, чтобы только лиганды акторы и в необходимых количествах могли участвовать в нужном процессе. Если доступных координационных мест будет больше, чем необходимо, на них могут усесться лишние лиганды-акторы, и даже такие, которые будут участвовать в побочных реакциях, снижая выход целевого продукта и селективность. Лиганды-спектаторы кроме того почти всегда осуществляют множество важных функций, например, обеспечивают растворимость комплексов, стабилизируют правильное валентное состояние металла, особенно если оно не совсем обычное, помогают отдельным стадиям, обеспечивают стереоселективность, и т.п. Пока не расшифровываем, потому что все это мы будем обсуждать подробно, когда доберемся до конкретных реакций.
Получается, что часть лигандов в координационной сфере должна быть прочно связанной и не склонной к диссоциации и замещению другими лигандами. Такие лиганды принято называть координационно стабильными. Или просто стабильными, если из контекста ясно, что речь идет о прочности связи лигандов, а не об их собственной термодинамической стабильности, которая как раз нас совершенно не волнует.
А лиганды, которые легко и охотно входят и выходят, и всегда готовы уступить место другим, называют координационно лабильными, или просто лабильными, и здесь, к счастью, никаких двусмысленностей нет.
Циклобутадиен как лиганд
Вот, наверное, самый яркий пример того, что в координационной сфере очень нестабильная молекула может стать отличным лигандом, причем по определению координационно стабильным, хотя бы потому, что если она рискнет выйти из теплой и уютной сферы наружу, ничего хорошего ее не ждет (ценой выхода будет как раз энергия антиароматической дестабилизации).
Циклобутадиен и его производные – самые известные примеры антиароматичности. Эти молекулы существуют только при низких температурах, и в сильно искаженном виде, – чтобы уйти как можно дальше от антиароматичности, цикл искажается в вытянутый прямоугольник, снимая делокализацию и максимально ослабляя сопряжение двойных связей (по другому это называется эффектом Яна-Теллера 2 рода: вырожденная система, а циклобутадиен-квадрат представляет собой вырожденный бирадикал, вспомните круг Фроста, – искажается и снижает симметрию, чтобы снять вырождение).
Но в комплексах циклобутадиен и замещенные циклобутадиены – отличные тетрагапто-лиганды, и геометрия таких лигандов – именно квадрат, с одинаковыми длинами связей. Как и почему это происходит – отдельная история, и далеко не такая очевидная, какой ее часто подают.
Координационно лабильные лиганды
Нужно понимать, что железобетонного забора с колючей проволокой и вышками охраны между областями лабильных и стабильных лигандов нет. Во-первых, это зависит от металла, и в этом контексте неплохо работает ЖМКО. Например, поздние переходные металлы предпочитают мягкие лиганды, а ранние – жесткие. Скажем, иодид очень крепко держится за d8 атомы палладия или платины, но редко вообще входят в координационную сферу титана или циркония в конфигурации d0. Но во многих комплексах металлов с не столь ярко выраженными признаками, иодид проявляет себя как вполне лабильный лиганд, легко уступающий место другим.
При прочих равных условиях:
- L-лиганды как правило лабильнее X-лигандов;
- лабильность X-лигандов определяется жесткостью/мягкостью и природой металла;
- очень лабильны “неявные” лиганды: растворители и мостики в димерах и кластерах, настолько, что их присутствием в координационой сфере часто вообще пренебрегают и рисуют структуры без них с формально ненасыщенной координационой сферой;
- дигапто-лиганды, например, алкены и алкины, ведут себя как типичные L-лиганды: они обычно вполне лабильны;
- лиганды с большей гаптностью редко бывают лабильны, но если полигапто-лиганд может изменять способ связи на моно-гапто, он становится более лабильным, так ведут себя, например, η3-аллилы;
- хелатные лиганды, образующие 5 и 6-членные хелатные циклы стабильны, а хелаты с меньшим или большим числом атомов цикле лабильны, по крайней мере по одному центру (хелатный цикл раскрывается и лиганд остается висеть как простой). Так ведет себя, например, ацетат;
Координационно стабильные лиганды
Повторим все еще раз, только с другой стороны
В координационной сфере металлов сохраняются (являются координационно стабильными) как правило:
- 5-ти и 6-членные хелаторы;
- полигапто-лиганды: чтобы вышибить из координационной сферы циклопентадиенилы или бензол (арены) приходится применять всякие специальные приемы – просто так они не выходят, часто выдерживая даже длительное нагревание;
- лиганды, связанные с металлом с высокой долей π-донорного эффекта (back-donation);
- мягкие лиганды у поздних переходных металлов;
- “последний” лиганд в координационной сфере.
Последнее условие выглядит странно, но представьте себе комплекс, у которого много разных лигандов, среди которых нет безусловно стабильных (нет хелаторов и полигапто-лигандов). Тогда в реакциях лиганды будут меняться, условно говоря, в порядке относительной лабильности. Наименее лабильный и останется последним. Такой фокус имеет место, например, когда мы используем фосфиновые комплексы палладия. Фосфины – относительно стабильные лиганды, но, когда их много, а металл богат электронами (d8, d10), они уступают, один за другим, место лигандам-акторам. Но последний фосфиновый лиганд обычно остается в координационной сфере, и это очень хорошо с точки зрения тех реакций, в которых эти комплексы участвуют. Мы еще вернемся к этой важной проблеме. Вот довольно типичный пример, когда от исходной координационной сферы фосфинового комплекса палладия в реакции Хека остается только один, “последний” фосфин. Этот пример очень близко подводит нас к важнейшей концепции в реакциях комплексов переходных металлов – концепции контролирующего лиганда (ligand control). Обсудим позднее.

Переметаллирование
При замещении одних лигандов на другие важно не переборщить с реакционной способностью входящего лиганда. Когда мы имеем дело с реакциями органических молекул, нам важно доставить в координационную сферу ровно по одной молекуле каждого из реагентов. Если вместо одной войдет две молекулы, высока вероятность побочных реакций с участием двух одинаковых лигандов. Возможна также и потеря реакционной способности из-за насыщения координационной сферы и невозможности введения в нее других необходимых для ожидавшегося процесса лигандов. особенно часто эта проблема возникает при введении в координационную сферу сильных анионных нуклеофилов, например, карбанионов. Чтобы избежать этого, используют менее реакционноспособные производные, в которых, вместо катиона щелочного металла, обусловливающего высокую ионность связи, используют менее электроположительные металлы и металлоиды (цинк, олово, бор, кремний, и т.п.), образующие ковалентные связи с нуклеофильной частью. Реакции таких производных с производными переходных металлов дают продукты замещения лигандов, в принципе, точно так же как если бы нуклеофил был в анионной форме, но из-за сниженной нуклеофильности с меньшими осложнениями и без побочных реакций.
Такие реакции замещения лигандов принято называть переметаллированием (transmetallation), чтобы подчеркнуть то очевидное обстоятельство, что нуклеофил как будто бы меняет металлы – более электроположительный на менее электроположительный. В этом названии, таким образом, заложен элемент малоприятной шизофрении – мы вроде бы уже договорились, что будем на все реакции смотреть с точки зрения переходного металла, но вдруг опять сорвались и смотрим на эту реакцию и только на эту реакцию с точки зрения нуклеофила. Придется потерпеть, так сложилась терминология и так принято. На самом деле, это слово восходит к ранней химии металлоорганических соединений и к тому, что действие литий или магнийорганических соединений на галогениды разных металлов и металлоидов – один из основных методов синтеза всякой металлоорганики, в первую очередь непереходной, и реакция, которую мы сейчас рассматриваем в химии координационных соединений переходных металлов – просто обобщение старинного метода металлоорганической химии, из которого она вся и выросла.
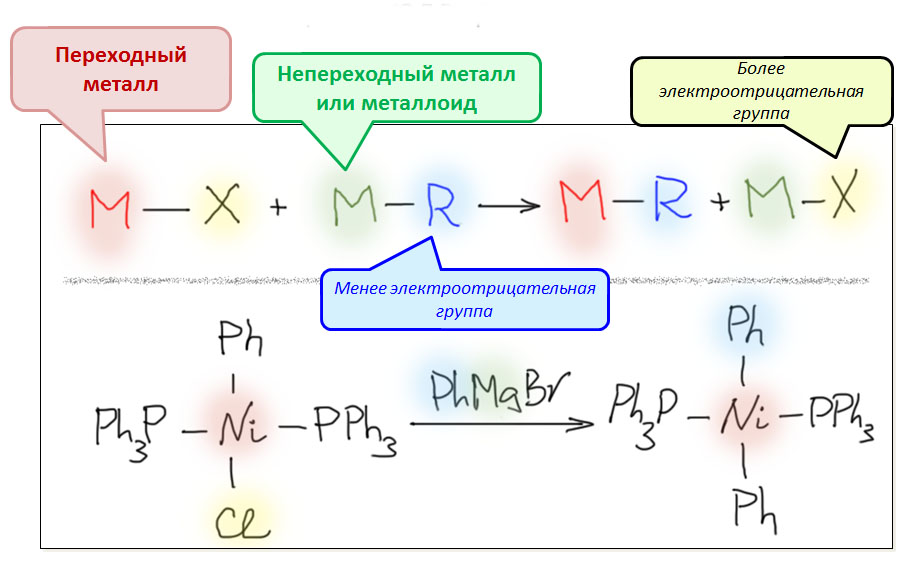
Как происходит переметаллирование?
Переметаллирование и похоже на обычное замещение, и не похоже. Похоже – если мы считаем непереходный металлоорганический реагент просто карбанионом с противоионом, то есть связь углерод-непереходный металл ионной. Но это представление похоже на правду только для самых электроположительных металлов – для магния. Но уже для цинка и олова это представление очень далеко от истины.
Поэтому в реакцию вступают две σ-связи и четыре атома на их концах. В результате образуются две новые σ-связи и четыре атома связываются друг с другом в другом порядке. Скорее всего, все это происходит одновременно в четырехчленном переходном состоянии, и сама реакция имеет согласованный характер, как и очень многие другие реакции переходных металлов. Обилие электронов и орбиталей буквально на все вкусы и все виды симметрий делает переходные металлы способными одновременно поддерживать связи в переходных состояниях с несколькими атомами.
В случае переметаллирования получаем частный случай очень общего процесса, который называется просто метатезисом σ-связей (σ-bond metathesis). Не путайте только с настоящими метатезисами олефинов и ацетиленов, которые являются полноценными каталитическими реакциями со своими механизмами. В данном случае речь идет о механизме переметаллирования или другого процесса, в котором происходит нечто подобное.
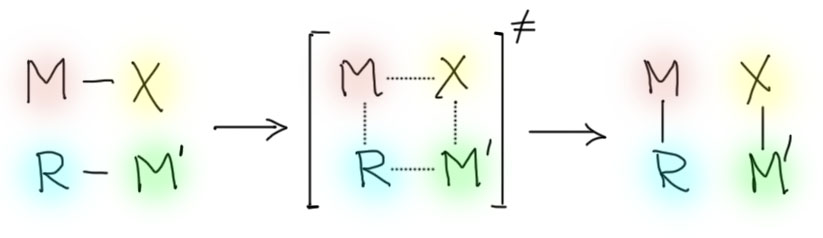
Вопрос
Гидридный комплекс рутения очень легко реагирует с ароматическими соединениями с образованием новых комплексов. Например, с бензолом образуется моно-ареновый комплекс.
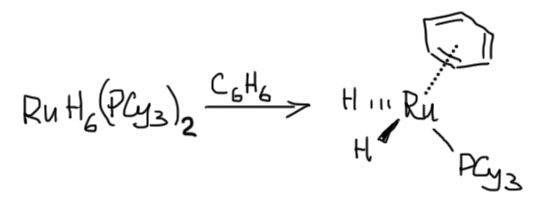
Предположите (или выясните любым другим способом), какую структуру имеет исходный комплекс по результату лигандного обмена. Ответ обоснуйте.
(A. F. Borowski et al. J. Mol. Cat. A 2001, 174, 69–79)
(до 10 баллов)