Реакция Судзуки-Мияуры
Наиболее важная реакция из большой четверки классических реакций кросс-сочетания использует в качестве нуклеофилов борорганические соединения. Причины такой влиятельности и славы многочисленны. и на первом месте здесь, безусловно, доступность борогранических соединений. Реакций, ведущих к разным борорганическим соединениям многие десятки, и традиционных, и новых, использующих ту же химию переходных металлов. Это позволяет легко получать борорганические соединения с практически любыми заместителями, насыщенные, ненасыщенные, ароматические, гетероциклические. При этом, сами бор-содержащие группы совместимы с практически любыми группами и фрагментами в остальной части молекулы. В ранние времена, когда бороорганические соединения были ограничены продуктами гидроборирования и борными кислотами, были некоторые сложности с гетероциклическими молекулами, так как бор в простых боранах и борных кислотах обладает льюисовой кислотностью и легко координирует основные атомы азота из гетероциклов, что приводит к низкой устойчивости таких борорганических соединений. Но в современном синтезе используется не менее дюжины других типов борорганических соединений почти на любой вкус, и многие из таких новых реагентов имеют четырехкоординированный бор без проблем с льюисовой кислотностью. Вот неполный список. Зачем так много? А чтобы было. Органический синтез немного похож на военные игры: синтетики любят словечки стиля military, например, арсенал. И арсенал должен ломиться от всяких разных штуковин, и чем больше тем лучше. На каждую цель – свое оружие. И точно так же как у вояк, новые виды оружия, целеустремлённо разрабатывавшиеся для поражения какой-нибудь особо важной цели, будучи по этой цели применёнными, обычно промахиваются и попадают куда-нибудь совсем в другое место. Создатели оружия в таких случаях сохраняют невозмутимость и уверяют, что так и было задумано. Когда-нибудь мы с этим арсеналом разберёмся подробнее, когда более важных вещей не останется. Пока просто посмотрим на это разнообразие и отметим, что до сих пор в практических применениях реакции Судзуки-Мияуры преобладают бораны, бороновые кислоты и циклические боронаты, часто называемые эфирами бороновых кислот по внешнему сходству со сложными эфирами других кислот. При этом стоит не забывать, что борная кислота и бороновые кислоты – весьма особенные соединения, не являющиеся протонными кислотами в полном смысле этого слова, но являющиеся кислотами Льюиса. Образование таких “эфиров” происходит не обычным образом для обычных кислородных кислот других неметаллов, а скорее как замещение лигандов на атоме бора в ассоциативно-дисоциативном механизме, так как атом бора координационно-ненасыщен. Вместо спорного слова “эфиры” люди, трепетно относящиеся к терминологии, часто предпочитают название диалкоксибораны, а то и производят их название по номенклатуре гетероциклов.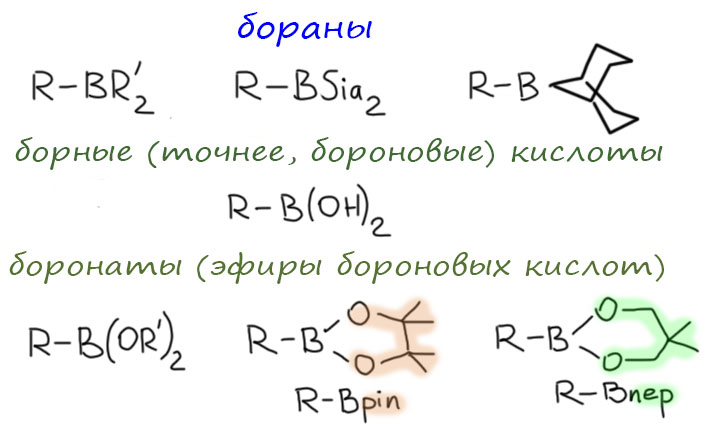
Два последних циклических “эфира” имеют в этой науке особое значение, и с ними мы будем дальше встречаться немало. Чаще встречается пятичленный, обычно называемый не имеющим никакого номенклатурного обоснования именем пинаколилборан, отсюда сокращение Bpin или B(pin), потому что это производное гликоля пинакона (по-английски pinacol). По гетероциклической номенклатуре это будут производные гетероцикла 1,3,2-диоксаборолана (4,4,5,5-тетраметил-1,3,2-диоксаборолана). Также довольно популярны производные шестичленного гетероцикла, производного гликоля, имеющего тривиальное название неопентилгликоль (сами догадайтесь, почему). Беда в том, что нормального названия от этого не получается, хотя в сокращении используют намёк на название гликоля Bnep или B(nep) (только не пытайтесь это назвать неопентилборан или неопентилгликолилборан!). Вот это, при острой необходимости как-то назвать, можно называть как гетероцикл – 1,3,2-диоксаборинаном (5,5-диметил). Странный порядок цифр в обоих гетероциклических названиях относится к порядку перечисления гетероатомов, сначала два кислорода, потом бор, нумерация начинается с кислорода. Если хотите указать и группу R, называйте ее с обозначением места присоединения 2 или B (например, если это этил, то будет 2-этил… или B-этил).
В современных вариантах реакции Суздуки-Мияуры стали применять много других производных бора. Во-первых, некоторые исследователи попробовали уйти от необходимости использовать основания для активации трёхкоординированного бора в боранах, бороновых кислотах и боронатах (диалкоксиборанах и циклических “эфирах”). А что если сразу взять четырёхкоординированный бор? Такие производные есть, они часто очень стабильны и удобны, представляют собой соли с некоторым простым противоионом. Правильно называть их боронаты, потому что они представляют собой производные бороновых кислот с присоединённым ещё одним лигандом – ат-комплексы, боронаты. Но в литературе распространено и менее аккуратное название бораты, особенно это относится к трифторборатам. Не могу не заметить, что надежды получить с такими производными кросс-сочетание без добавления оснований не вполне оправдались – ниже будет рассказана почти детективная история о том как Гэри Моландер мучился с трифторборонатами – но они нашли свою нишу в синтезе для некоторых специфических задач.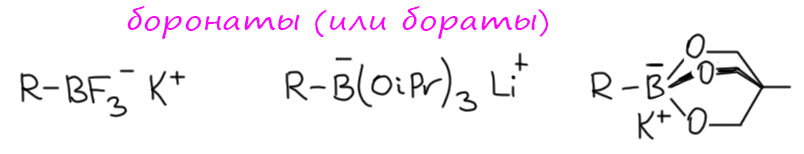 И последняя пачка совсем необычных производных появилась совсем недавно. Эти производные нужны для очень специальных задач, но особенно хороши тогда, когда в одном сложном синтезе нужно делать несколько кросс-сочетаний, тогда использование разных борных остатков позволяет развести их во времени. Кроме того, эти производные возникают в разных совсем современных методах синтеза борограники. “Секрет” их в том, что атомы азота практически полностью уничтожают донорным мезомерным эффектом кислотность Льюиса атома бора, а это приводит к тому, что такие соединения невозможно активировать к переметаллированию. И если в молекуле одновременно есть другие борные группы, их можно успешно пустить в кросс-сочетание. Другими словами, такие группы временно маскируют бор. Когда дело доходит до этих групп, их различными способами превращают в обычные (демаскируют) и тоже пускают в кросс-сочетание.
И последняя пачка совсем необычных производных появилась совсем недавно. Эти производные нужны для очень специальных задач, но особенно хороши тогда, когда в одном сложном синтезе нужно делать несколько кросс-сочетаний, тогда использование разных борных остатков позволяет развести их во времени. Кроме того, эти производные возникают в разных совсем современных методах синтеза борограники. “Секрет” их в том, что атомы азота практически полностью уничтожают донорным мезомерным эффектом кислотность Льюиса атома бора, а это приводит к тому, что такие соединения невозможно активировать к переметаллированию. И если в молекуле одновременно есть другие борные группы, их можно успешно пустить в кросс-сочетание. Другими словами, такие группы временно маскируют бор. Когда дело доходит до этих групп, их различными способами превращают в обычные (демаскируют) и тоже пускают в кросс-сочетание. 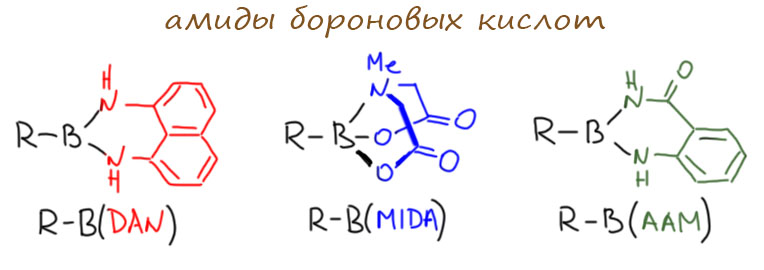
Таких производных предложили довольно много, но самые популярные это производное диаминонафталина B(DAN) (того самого, производным которого является Протонная Губка) и производное N-метилиминодиацетата B(MIDA). Время от времени мелькает ещё производное амида антраниловой кислоты B(AAM), и ещё несколько экзотических систем.
Переметаллирование с бор-органическими соединенями нуждается в содействии.
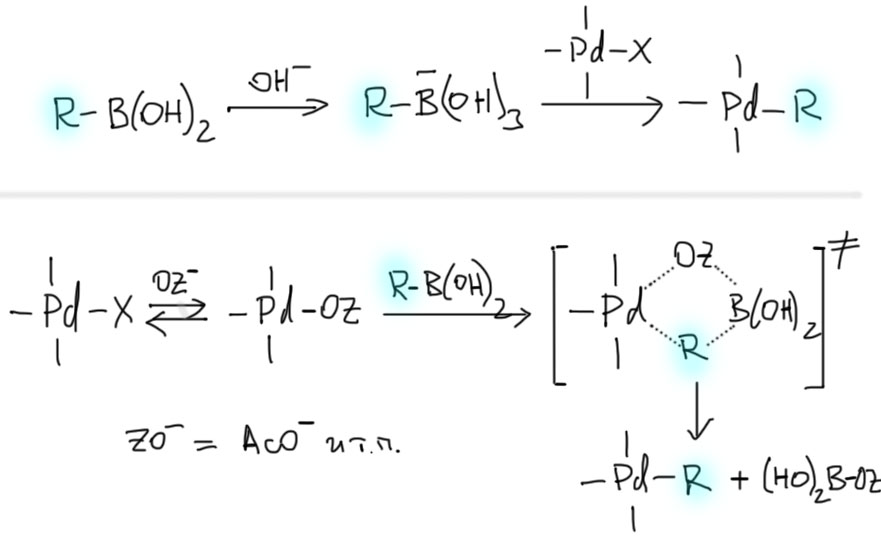
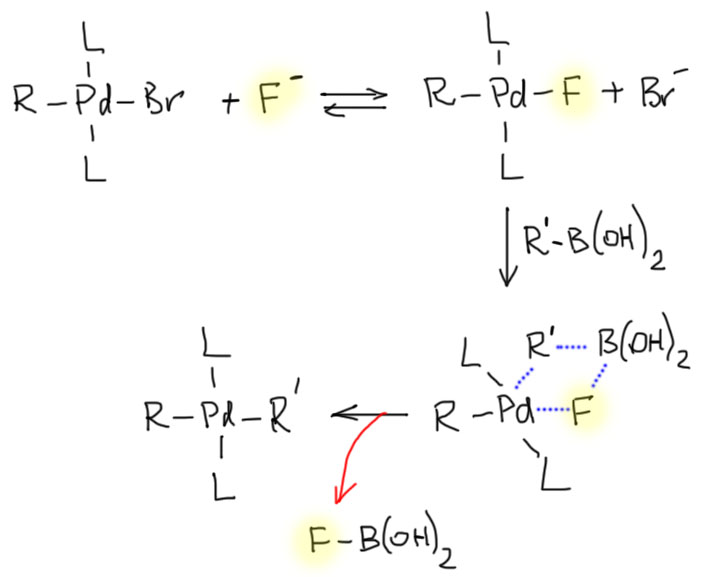
Каталитический цикл типичен для реакций кросс-сочетания, идущих через переметаллирование. Главная проблема – низкая реакционная способность связи C-B к переметаллированию – бор все же тот еще металл, и связь C-B малополярна и весьма прочна. Разрыв связи C-B со смещением электронной плотности к углероду осложнен еще и тем, что бор является уже секстетным атомом с неполной электронной оболочкой, и попытка ободрать его еще, лишив еще пары электронов выглядит изрядной наглостью. Поэтому нужно сделать одно из двух – либо сначала дать бору еще один заместитель, дополнив оболочку до октета; либо обменяться с переходным металлом заместителями максимально согласованно, так чтобы дополнительный дефицит электронов не возникал. Работают оба пути, причем в каждом конкретном случае невозможно точно сказать, что происходит. Но почти всегда работает одна и та же особенность бора – он очень любит кислород и с удовольствием берет кислородные нуклеофилы в качестве лигандов (используем слово лиганд и для обозначения заметителей на атоме бора).
Это можно сделать двумя способами. Сначала загрузить кислородный нуклеофил (гидроксид-ион или что-то типа этого) на бор, и пустить такой четырехкоординированный боронат в переметаллирование. Или сначала заменить лиганд на переходном металле, и затем осуществить переметаллирование по механизму метатезиса σ-связей. И в одном, и в другом механизме нужен кислородный нуклеофил (он же лиганд, он же основание Льюиса), про который так и говорят – он оказывает содействие (lends assistance), или еще точнее – нуклеофильное содействие (nucleophilic assistance).
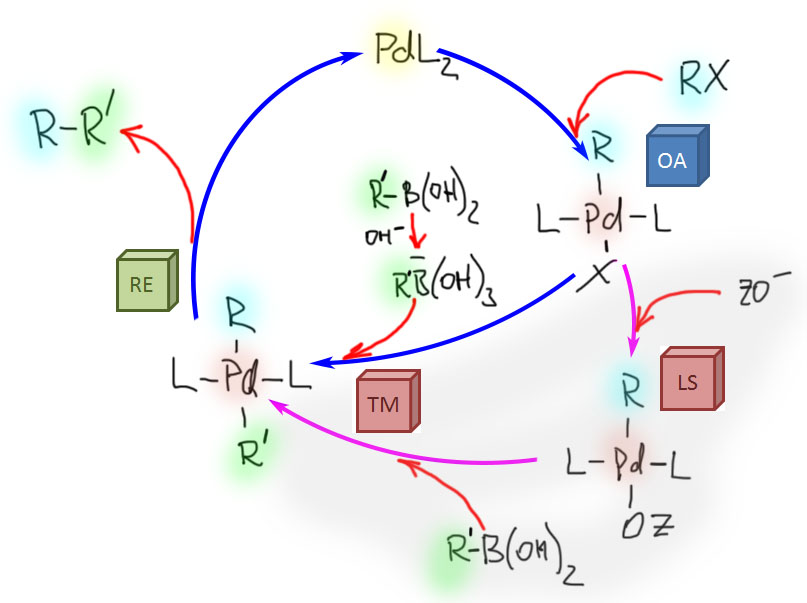
Каталитический цикл реации Судзуки-Мияура
С учетом специфики переметаллирования каталитический цикл реакции Судзуки-Мияура типичен для классического кросс-сочетания: окислительное присоединение – переметаллирование – восстановительное элиминирование. Соответственно, может быть два варианта цикла, различающихся стадией переметаллирования. Более распространенным является цикл с участием четырехкоординированного производного бора, и именно поэтому реакции Судзуки-Мияуры чаще всего делают в присутствии водной щелочи или других простых оснований (карбонатов, фосфатов и т.п.) в присутствии небольшого количества воды. В водной среде почти любое основание можно представлять как гидроксид-ион.
Борные кислоты в реакции Судзуки-Мияура
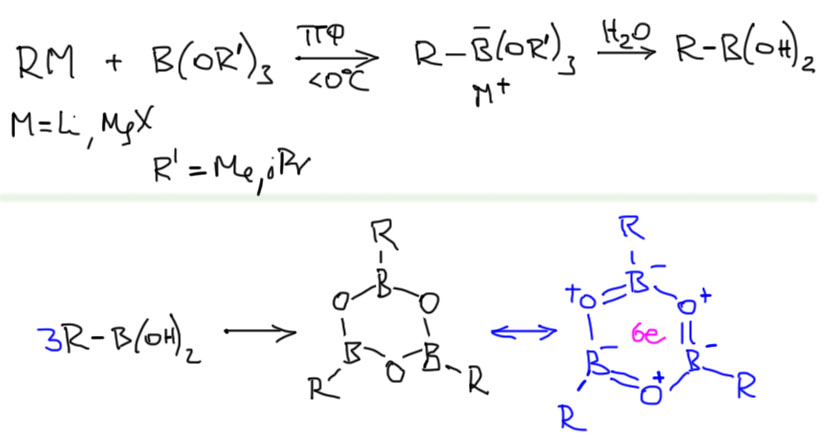
Основным типом бороорганических соединений для кросс-сочетания являются так называемые борные (правильнее – бороновые, всегда кислородные кислоты с одним органическим остатком называются с суффиксом -оновые: карбоновые, сульфоновые, фосфоновые, и т.д.) кислоты. традиционный метод их синтеза прост – литийорганические соединения или реактивы Гриньяра реагируют с эфирами борной кислоты, метиловым или изопропиловым, с последующим гидролизом. Несмотря на простоту реакции эти довольно капризны и предъявляют повышенные требования к экспериментальным умениям. При недостаточном контроле условий (реакции ведут при охлаждении и эффективном перемешивании) получаются всякие побочные продукты. Огромное количество готовых борных кислот есть в каталогах компаний, торгующих реактивами. Борные кислоты не лишены недостатков. Они не очень хорошо хранятся, так как подвержены нескольким превращениям.
Одно из них довольно занятно. Тримеризация борных кислот с дегидратацией дает вещества, которые называют ангидридами борных кислот или бороксинами – это плоские симметричные шестичленные кольца, в которых чередуется бор и кислород. Нечто подобное – боразины – довольно часто всплывает при обсуждении ароматических соединений, как пример ароматического цикла без единого атома углерода (такие молекулы иногда называют неорганическими бензолами). Бороксины изоэлектронны и изоструктурны боразинам, поэтому довольно понятно, отчего они так легко образуются, хотя в литературе нет определенного мнения о том, насколько действительно они ароматичны. В принципе, бороксины должны гидролизоваться в условиях реакции Судзуки-Мияуры с участием водной щелочи, но есть подозрение, что делают они это весьма неохотно. С ароматичностью, даже такой эфемерной расставаться никому не охота.
В результате, в реальных реакциях почти всегда используют избытки борных кислот. Небольшие, редко превышающие 50%, но все равно избытки. Если борная кислота сложная и дорогая, это не самые хорошие новости. Поэтому, хотя борные, точнее бороновые, кислоты и остаются самым главным бороорганическим субстратом для кросс-сочетания, поиски альтернативных соединений, лучше хранящихся и не склонных к побочным реакциям, продолжаются.
Фторид-ион в реакции Судзуки-Мияуры
Классический вариант реакции великолепен и мощен, но у него тоже есть изъяны. Один из них связан с тем, что в качестве основания используется гидроксид-ион или что-то другое, но, так как реакция почти всегда идет в присутствии воды, любое основание фактически работает как гидроксид. Если в сочетающихся молекулах есть группы, реагирующие с гидроксидом, то у нас проблемы. А таких групп множество – все, что может гидролизоваться, например.
Нужно искать безводные протоколы кросс-сочетания. Это не так просто, как кажется. Но одна идея довольно быстро пришла в головы исследователей. Бор любит не только кислород, но и фтор. О, бор очень любит фтор! Это знают все, кто знает хоть что-нибудь про бор. Борная кислота превращается в тетрафторбористую при действии HF в водном растворе, но тетрафторборная кисота и её соли вполне гидролитически устойчивы. Уже это довольно ясно показывает, что бор любит фтор больше кислорода.
И раз, как мы видели из каталитического цикла, для переметаллирования нужно, чтобы на бор сел еще один анион, то ничего лучше фторида и найти. Здесь есть одна проблема – фториды имеют очень прочные кристаллические решетки (фторид – очень маленький анион, и кулоновское притяжение к катиону поэтому огромно и разрушить такие решетки может только протонный растворитель, выдающий взамен электростатического притяжения водородную связь). Использовать с фторидом протонный растворитель по разным причинам не всегда удобно, а апротонные растворители не могут разрушить кристаллические решетки фторидов. Нужен, например, межфазный перенос, или – взять самый большой катион, и тогда мы получим максимально возможное ослабление притяжения катион-анион. Самый большой катион – это цезий. Да, действительно, именно соли цезия обычно используют, когда хотят получить хоть какую-то растворимость солей с небольшими анионами. именно этим объясняется просто невероятная популярность карбоната цезия в реакциях кросс-сочетания. И если мы хотим фторид, то выбор падает на фторид цезия.
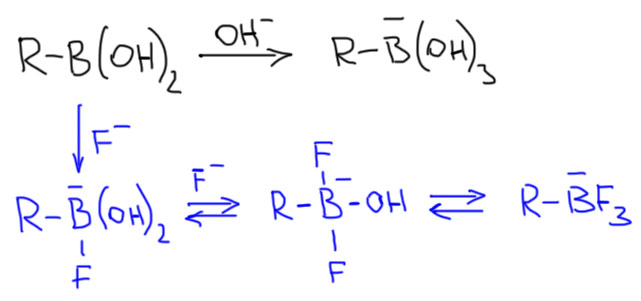
Такой протокол был предложен довольно давно (SW Wright et al, JOC, 1994, 6095) и оказался весьма недурным. Вот, например, как осуществить кросс-сочетание с субстратом, имеющим сложноэфирную группу, которая нацело бы гидролизовалась в классическом протоколе с водной щелочью.
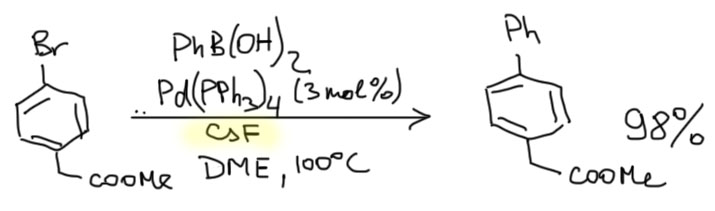
В той же реакции можно использовать и KF, но тогда обязательно нужна добавка протонного растворителя типа метанола или воды, и тогда выходы и селективность падают.
Протокол неплохо зашел в синтез, и с тех пор неоднократно использовался. Но дальше началась немного детективная история.
Многим почти сразу же пришла в голову мысль – а что если сразу превратить борную кислоту в фторборат. Это очень просто сделать, и, более того, быстро выяснилось, что такие фторбораты очень легко выделяются и отлично хранятся, с ними нет проблем с тем же образованием бороксинов. Можно прямо выделять эти фторбораты вместо борных кислот. Разработали несколько удобных и практичных протоколов.
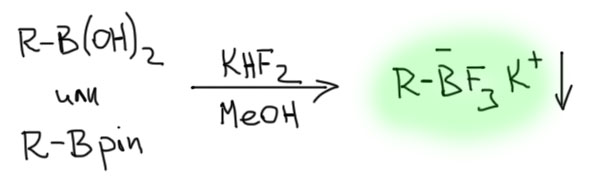
Как любят писать в таких случаях в пафосных статьях – сцена была готова для великого свершения. Ведь такие вещества должны были реагировать в кросс-сочетании вообще без добавления основания – бор-то уже октетный, четырехкоординированный, по всем теориям кросс-сочетания готовый к переметаллированию.
Но вместо великого свершения, как часто бывает, произошел просто эпический облом.
Трифторбораты в реакции Судзуки-Мияуры
Трифторбораты замечательно реагируют в реакции Судзуки-Мияура. Но – в тех же самых условиях, что и борные кислоты, то есть в присутствии воды и… оснований. Основания-то зачем, за что боролись? Вот типичный протокол
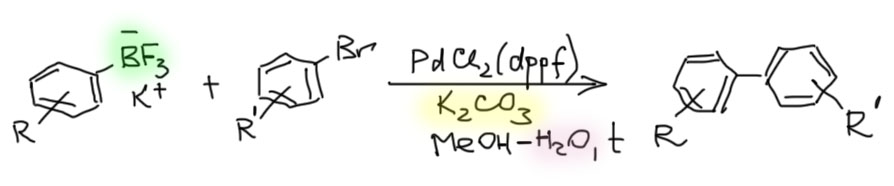
Довольно быстро выяснилось, что трифторбораты не работают в переметаллировании. Это довольно легко понять, хотя и непросто было предсказать – задним числом все умные. Несмотря на то, что бор в таких солях четырехкоординированный и несет формальный отрицательный заряд, высочайшая электроотрицательность фтора не может не влиять на свойства этой группы. Трифторборатный анион изоэлектронен трифторметильной группе, которая является сильным акцептором. Поэтому можно считать, что связь углерод-бор в трифторборатах испытывает влияние акцептора и становится недоступной для переметаллирования. Нам-то нужно было, чтобы связь поляризовалась в другую сторону – в сторону углерода. А она получается поляризуется в обратную сторону и становится ещё крепче и ещё более ковалентной (с меньшей степенью ионности), чем была.
Вместо этого всегда сначала происходит гидролиз трифторбората в старую добрую борную кислоту, которая и реагирует в привычных условиях. Трифторборат – только предшественник (прекурсор) борной кислоты. Можно спросить, а почему происходит гидролиз – ведь мы только что уверяли в том, что бор и фтор соединяет совершенно нечеловеческая страсть. Соединять-то соединяет, но и кислород для бора – желанный элемент, хотя и уступающий фтору. В таких случаях все решают концентрации – просто воды в реакционной смеси много по сравнению с трифторборатом, даже 10%-ная добавка воды в растворитель, если прикинуть по молям, это всегда большой избыток. Поэтому частично происходит гидролиз, а поскольку борная кислота расходуется в реакции, то равновесие понемногу смещается, как и положено по Ле Шателье. То есть никто не утверждает, что трифторборат количественно гидролизуется в борную кислоту, как только попадает в реакционную смесь. И это очень хорошо, потому что это означает, что во время реакции большая часть борорганики остается в виде фторборатов, а они более устойчивы в условиях реакции к малоприятным побочным реакциям, например, протодеборирования (замена борного остатка на протон) и окислительного гомосочетания.
Уже одно это создает для трифторборатов хорошую нишу в реакции Судзуки-Мияуры – они удобнее в работе, лучше хранятся, и часто дают заметно лучшие выходы, чем соответствующие борные кислоты, даже несмотря на то, что условия реакций почти одинаковы. Развитием химии трифторборатов занялся очень упорный и изобретательный Гэри Моландер из Пенсильвании, который нашел для них множество полезных применений, и смог, по крайней мере частично отыграть несбывшиеся поначалу надежды (обзор его усилий можно посмотреть G.Molander, Organotrifluoroborates: protected boronic acids that expand the versatility of the Suzuki coupling reaction, Acc.Chem.Res., 2007, 40, 275).
Пример кросс-сочетания с участием трифторборатов
Вот пример кросс-сочетания с циклопропильным производным. Условия типичны для реакции Судзуки-Мияуры с обычными борными кислотами – двухфазная система толуол-вода очень популярна в этой химии. Используется щадящее основание, фосфат калия, чтобы невзначай не угробить енолизуемый кетон. Обратите внимание на сохранение стереохимической конфигурации.
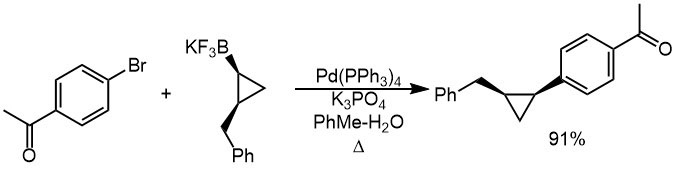
Так что же делает фторид-ион в реакции Судзуки-Мияуры
Итак, трифторбораты мы на место поставили, но по дороге убедились, что их образованием невозможно объяснить, почему фторид-ион можно использовать в качестве основания в реакции Судзуки-Мияуры. Чтобы продвинуться дальше, мы должны обратить внимание на один парадокс. Мы везде называем этот реагент в реакции Судзуки-Мияуры основанием, но сами-то точно знаем, что его роль в реакции ни разу не сводится к банальной основности. Это – лиганд, либо на боре, либо на палладии, в зависимости от того, какой из механизмов активации переметаллирования работает в том или ином случае. Пока мы были ограничены кислородными основаниями типа гидроксид-иона, большой беды в некоторой неразборчивости в терминах не было. Но когда мы переходим к фториду, слово “основание” вызывает ненужные воспоминания и сбивает с толку.
Фторид в любом случае – просто лиганд. Но его связывание с бором (которое происходит) не дает нам ничего, потому что уже выяснили, что такие частицы хуже в переметаллировании. Остается только та же ситуация, которая была и с кислородными основаниями-лигандами. Если фторид заберется на атом палладия, заместив на нем более тяжелый галоген, то такой комплекс будет участвовать в переметаллировании по тому же принципу – каждый получает то, что больше любит: бор – фтор, палладий – углерод. Осталось понять, действительно ли фторид может заместить более тяжелый галогенид на палладии – ведь палладий точно предпочитает более мягкие галогениды более жестким. Это хорошо известно, и определяет очень многое в поведении палладиевых комплексов в реакциях кросс-сочетания с разными галогенпроизводными. Палладий любит иодид больше чем бромид, а бромид – больше чем хлорид. С фторидом возникает некоторая заминка, потому что фторпроизводные не участвуют в реакциях кросс-сочетания с палладиевыми катализаторами, и встретиться с фторидными комплексами раньше шансов не было.
Разобраться с тем, действительно ли фторид может замещать более стабильные лиганды на палладии удалось французской исследовательнице Ани Жютан, знаменитой работами как раз по выяснению тонких деталей механизмов. С помощью электрохимии и других методов действительно удалось показать (Jutand, Grimaud, Synthesis, 2016, 48), что фторид входит в координационную сферу палладия и переметаллирование направляется по пути метатезиса σ-связей. Более того, фторид ускоряет и восстановительное элиминирование, но это уже более тонкий эффект, и мы им пренебрежем.
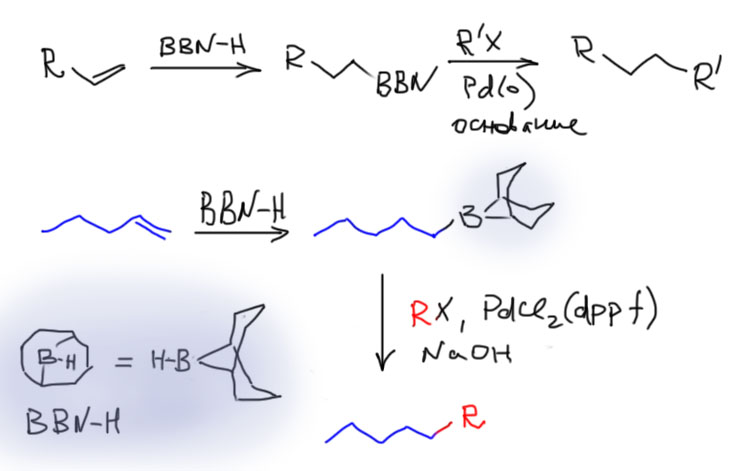
Гидроборирование
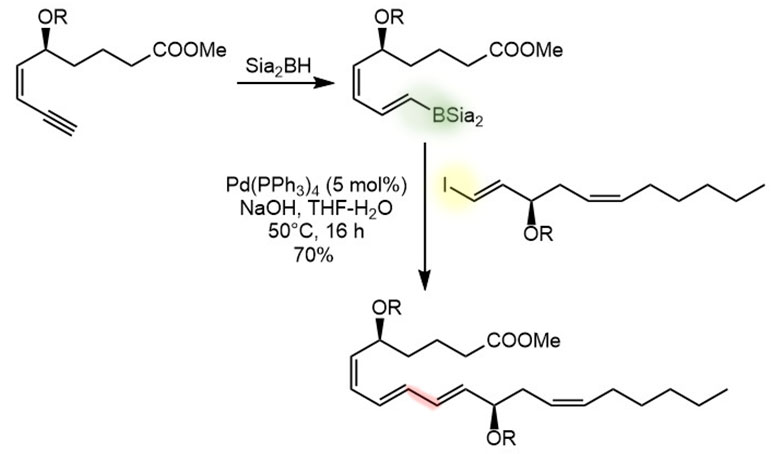
Реакция гидроборирования алкенов и алкинов – один из надежных и хорошо известных способов получения борорганики для кросс-сочетания. Чаще всего для гидроборирования применяют 9-BBN-гидрид, но используют и другие бораны, в частности известный нам по 3 курсу дисиамилборан. Почти всегда в реакцию гидроборирования вступают концевые монозамещенные двойные и тройные связи, а внутренние, ди и тризамещенные связи не гидроборируют, так как это а) намного медленнее, б) в случае несимметричного замещения региоселективность гидроборирования невелика. Региоселективность гидроборирования определяется в основном стерическими факторами, а не электронными, поэтому бор почти всегда прицепляется к самому незамещенному и легкодоступному атому углерода.
В реакциях с алкилборанами (продуктами гидроборирования олефинов) очень часто используют dppf в качестве лиганда, что, как мы уже выяснили, повышает скорость восстановительного элиминирования и подавляет побочные реакции. Но нередко и использование других лигандов – конкретный протокол определяют экспериментально.
Пример sp2-sp3-кросс-сочетания через гидроборирование
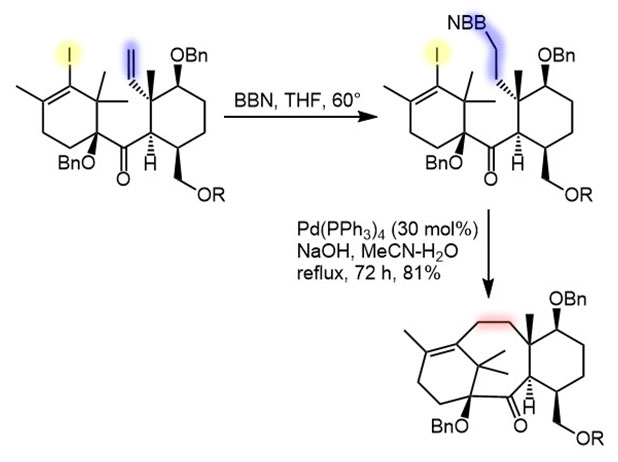
Пример sp2-sp2-кросс-сочетания через гидроборирование