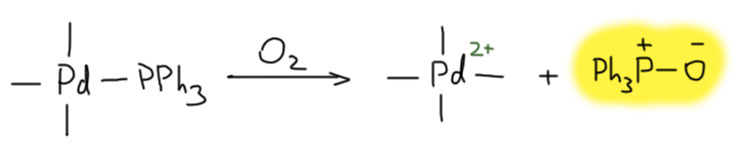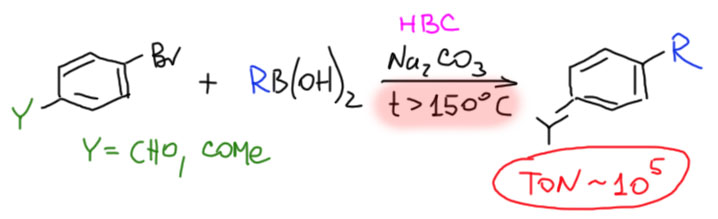Каталитические процесс в практике органического синтеза
Прежде чем двигаться дальше самое время немного подробнее остановиться на катализе. Как уже было и не раз сказано, применение переходных металлов в органическом синтезе – это не обязательно катализ. Но катализ в химии – одна из самых важных областей. “Катализ – это химия будущего” – как в воду глядел из почти столетней давности один из самых ярких представителей российской химии, а по совместительству ещё и отец американской химической промышленности, Владимир Ипатьев. И хотя он имел в виду не совсем то, что мы сейчас изучаем, но трудно не заметить, что без катализа современная органическая химия мертва как ржавый гвоздь – ничего кроме нитробензола она сделать не сможет. Ах, чёрт, и для нитробензола тоже нужен катализ! Да и получить его можно не только старым и не очень добрым нитрованием, а современными методами с использованием комплексов переходных металлов (впрочем, это небольшое преувеличение, в современной промышленности нитробензол продолжают получать нитрованием бензола, только очень тщательно оптимизировав процесс и минимизировав отходы).
Что интересует исследователя, занимающегося разработкой каталитических методов и протоколов? И почему вообще нужно их разрабатывать после того как, скажем, Судзуки и Мияура опубликовали свою основополагающую статью?
Ответ достаточно прост: человек, а химик это человек, сомненья в этом нет – всегда делает только то, что приносит какой-то результат. Когда мы говорим о катализе в органическом синтезе, результат – это улучшение. Видимо, оригинальный метод из статьи основоположников далёк от идеала, и его можно улучшить, и тогда этим стоит заниматься. С точки зрения органического синтеза, улучшить – значит повысить выходы, сделать метод более удобным и робастным. Это словечко из матстатистики очень удобно означает малую чувствительность ко всяким косякам и ошибкам – хороший метод должен быть снисходителен к недостатку опыта экспериментатора и не сходить с рельсов просто от того, что его выполняет не Боб Вудвард и не Самуил Данишефски, и не другие легендарные синтетики недавнего и более далёкого прошлого. Более селективным. Ну и в современном контексте придётся еще попробовать пройти экспертизу Греты Тундберг – постараться убедить, что выполнение синтеза по данной методике не приведёт к увеличению пластмассового острова в океане и не приблизит разогревание планеты на 5 градусов. В наше время это называется “зелёной химией” и считается почти обязательным.
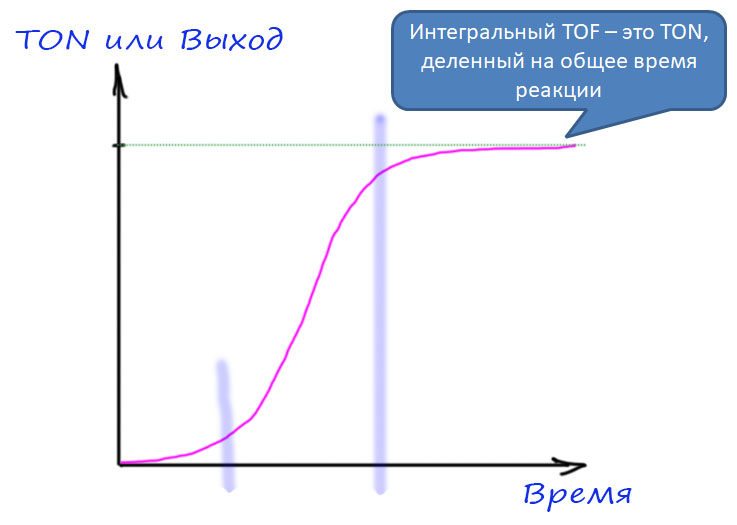
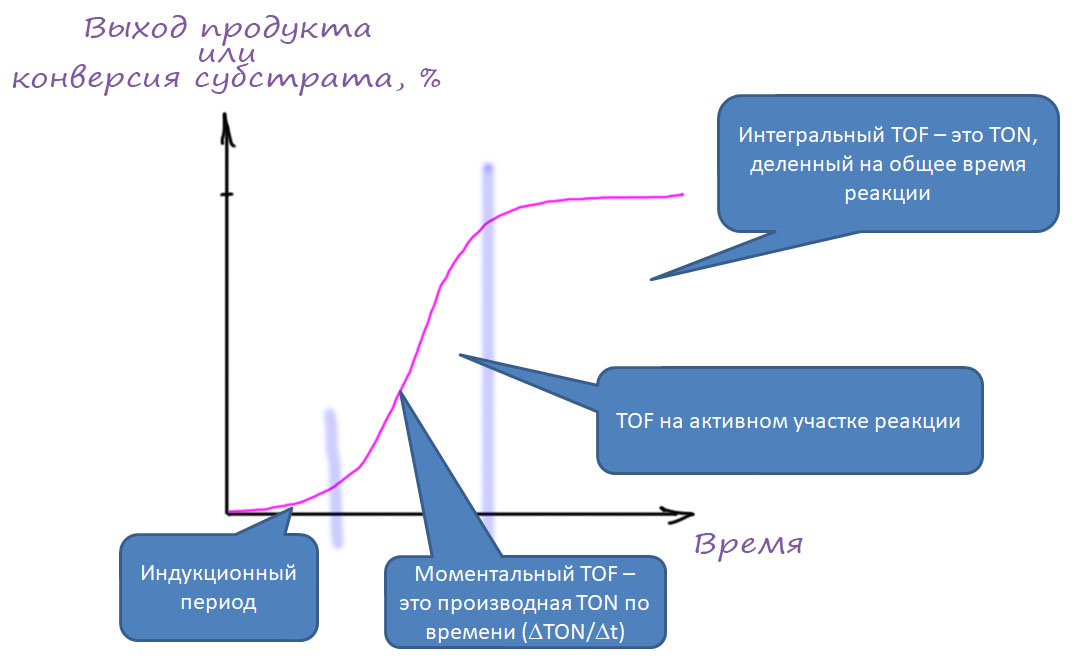
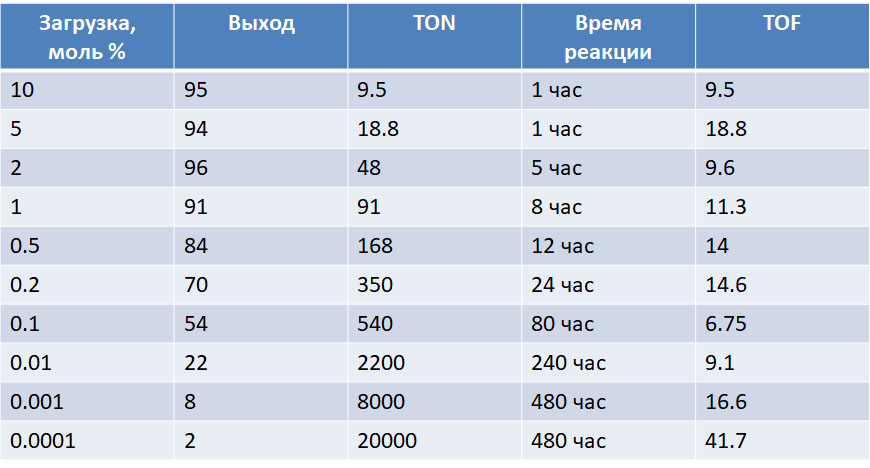
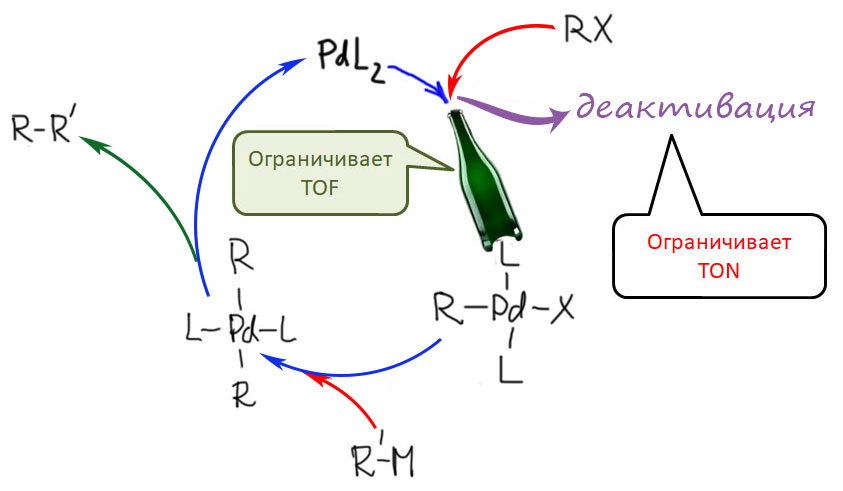
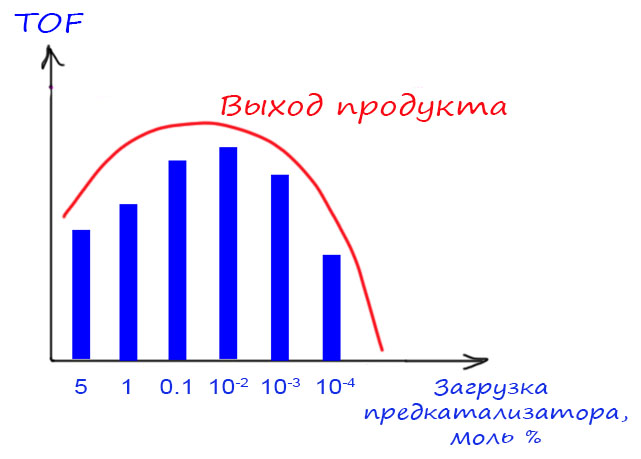
А что это значит с точки зрения катализа? В принципе то же самое, только в специфических терминах каталитических процессов. Мы не будем рассматривать тонкости кинетики каталитических реакций и тому подобные сложности, которые при желании можно изучить в специальных курсах. Нас будут интересовать простые и очень доступные характеристики каталитических процессов, которые можно даже не измерять специально, а просто прикинуть из данных в методике – длительности реакции, количеств реагентов и катализатора, выхода продуктов. Эти характеристики, если их применять с пониманием того, что они собственно говорят, дают неплохое представление о сравнительных возможностях разных методов. И они же очень часто используются для попыток манипуляции – неразборчивый читатель “клюёт” на красивые цифры и получает совершенно неадекватное представление о том, что собственно сделано в очередной работе с громким заголовком. В современной химии, увы, броские заголовки в научных журналах стали столь же наглы и обманчивы, как в таблоидах о жизни третьесортных звёзд. Если не научиться в этом разбираться, можно решить, что все проблемы человечества уже решены и перерешены, от отчаяния бросить химию и податься в биндюжники. Не нужно бросать химию от отчаяния – в химии ещё полно нерешённых задач, их ненамного меньше, а точнее гораздо больше, чем десять, пятьдесят, сто лет назад.
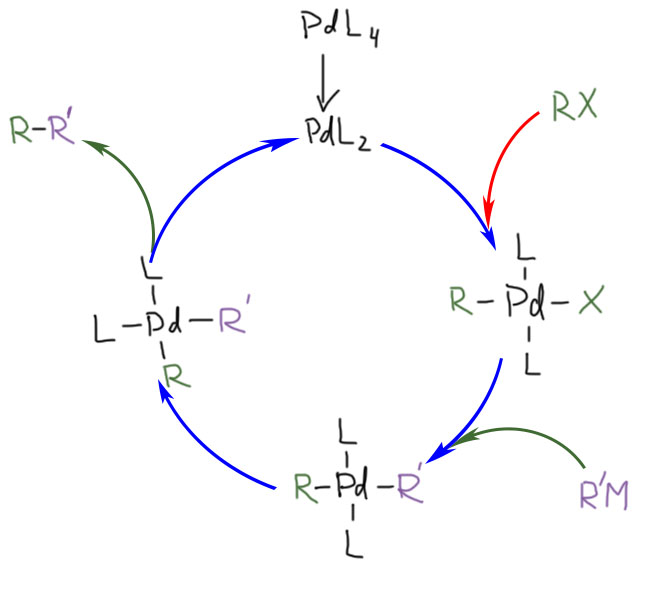
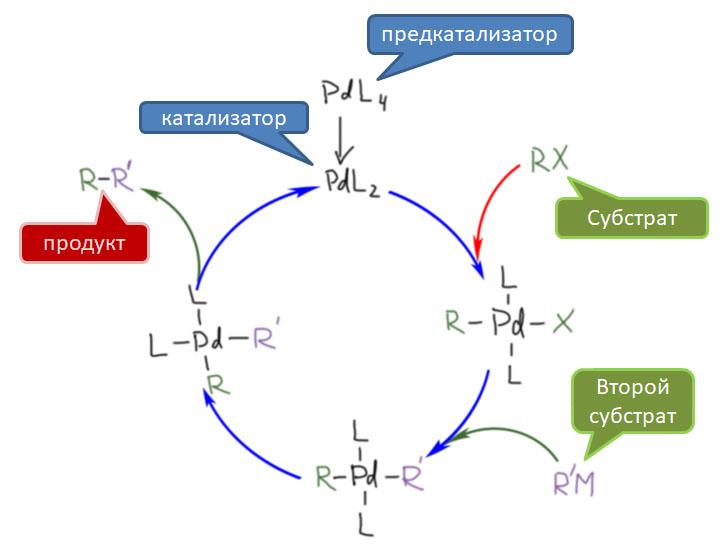
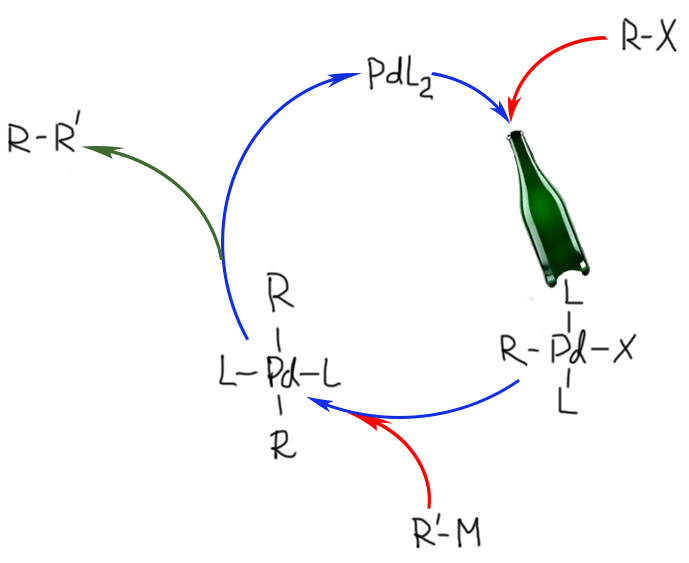
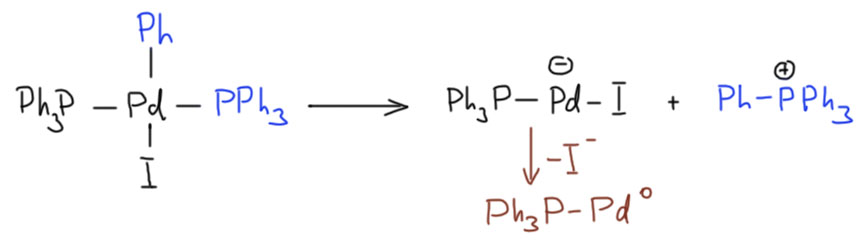
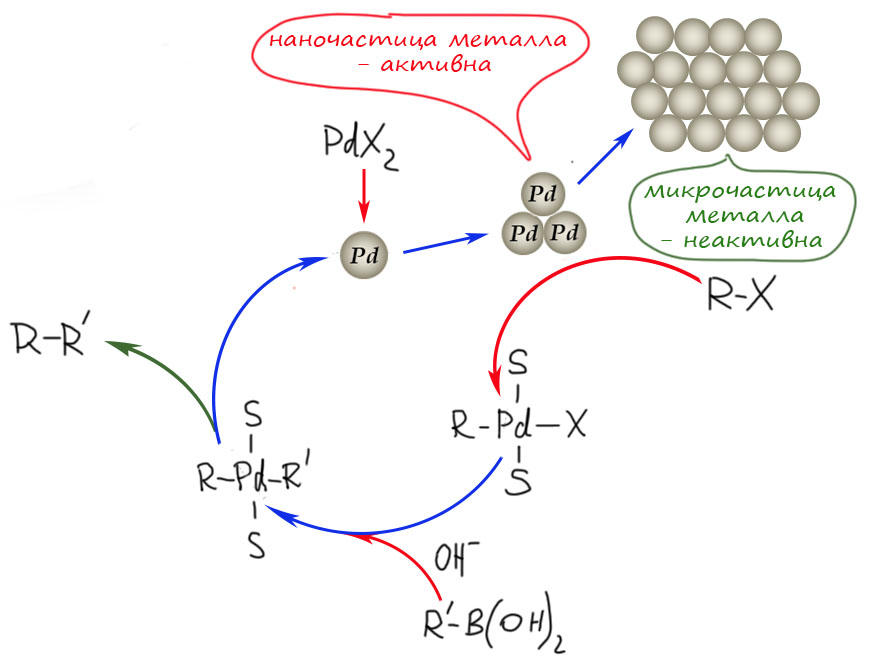
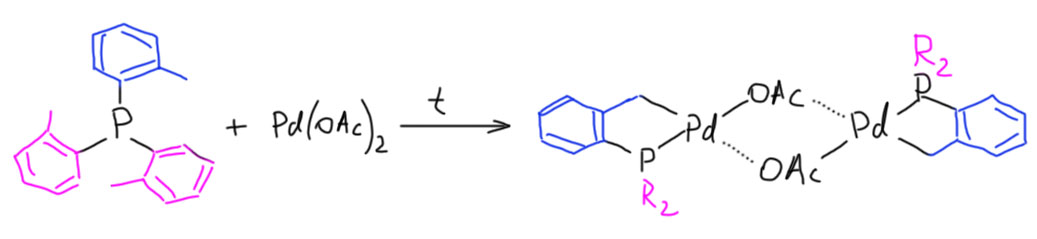
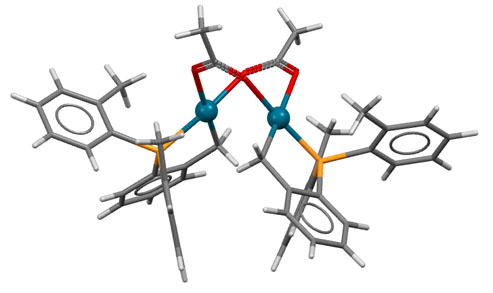
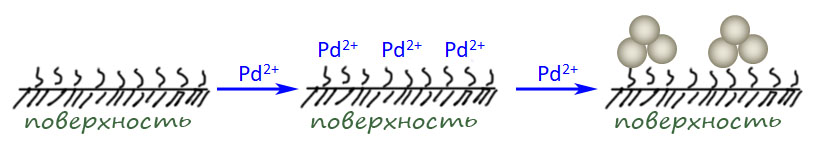
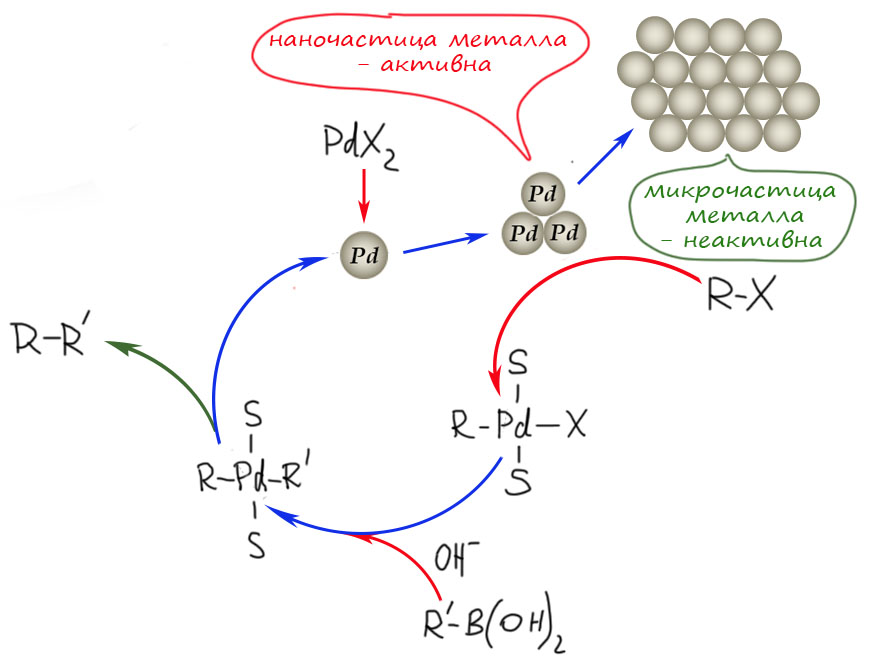
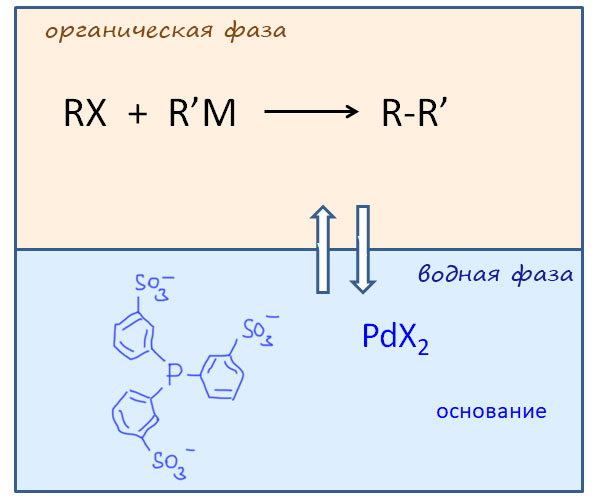
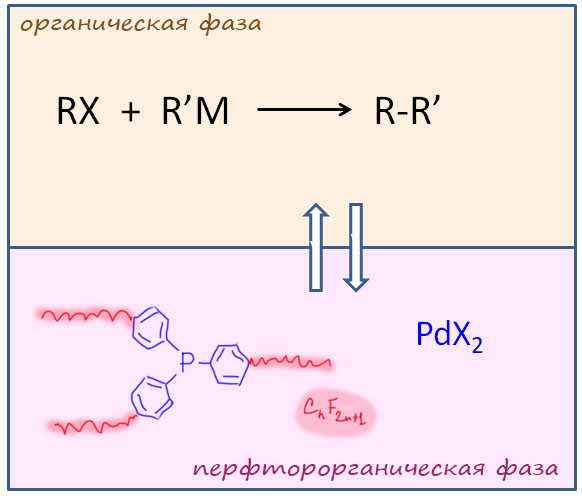
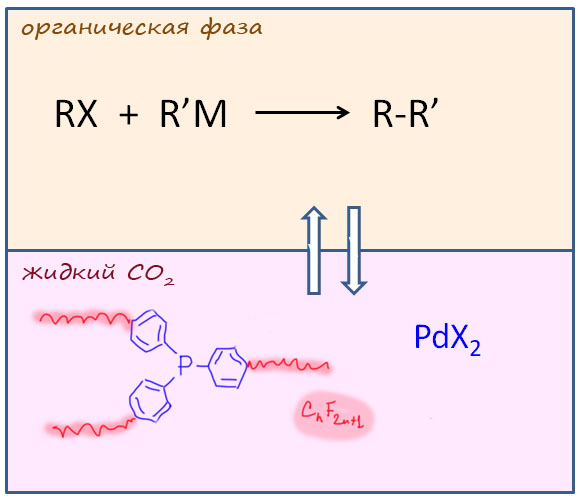
В кросс-сочетании палладиевые катализаторы обычно используют фосфиновые лиганды. Но не всегда – есть немалое количество методов, в которых фосфин не используется. Как они работают, и какое отношение к этому имеют модные нано-частицы металла посмотрим в следующем разделе.
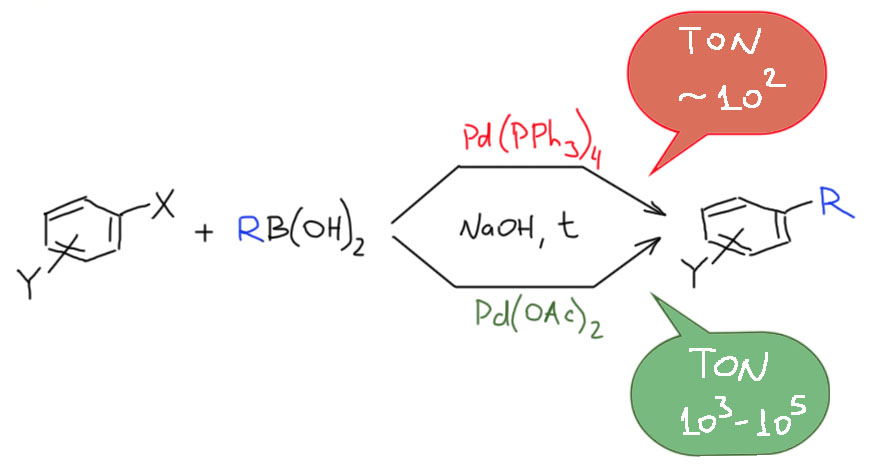
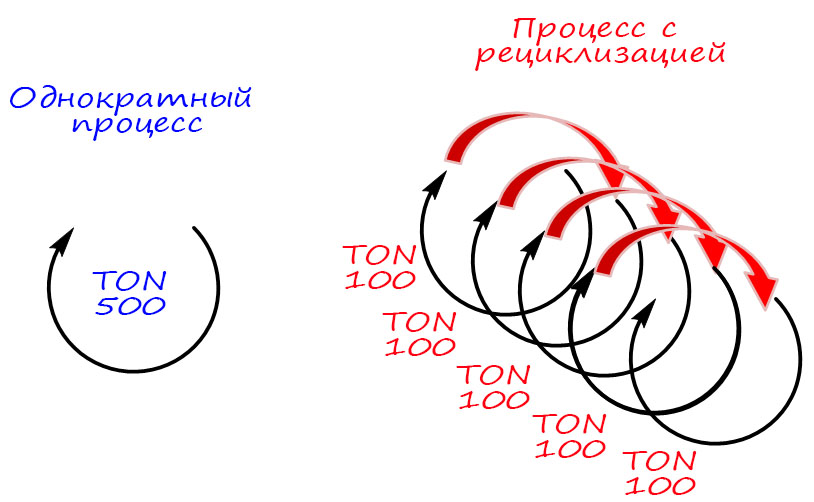
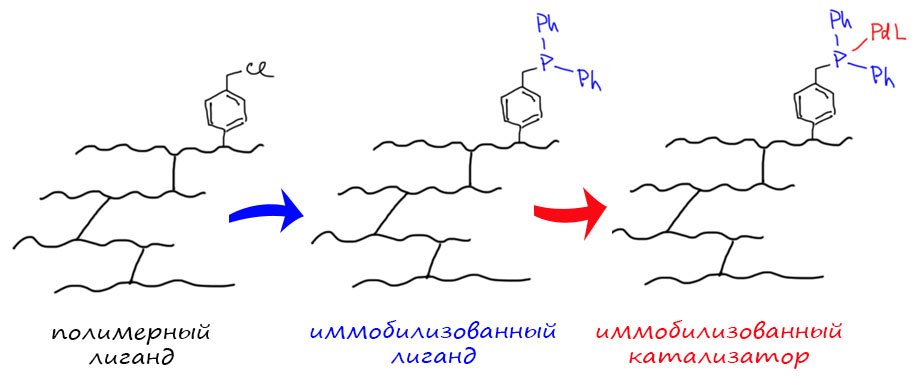
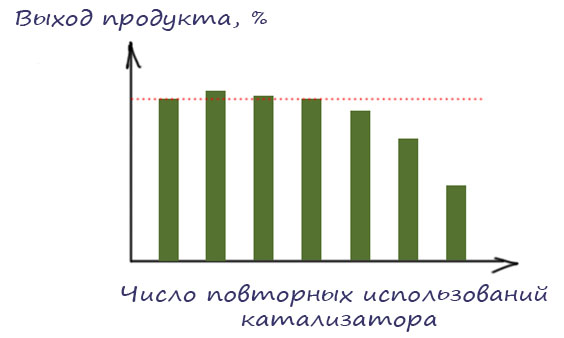
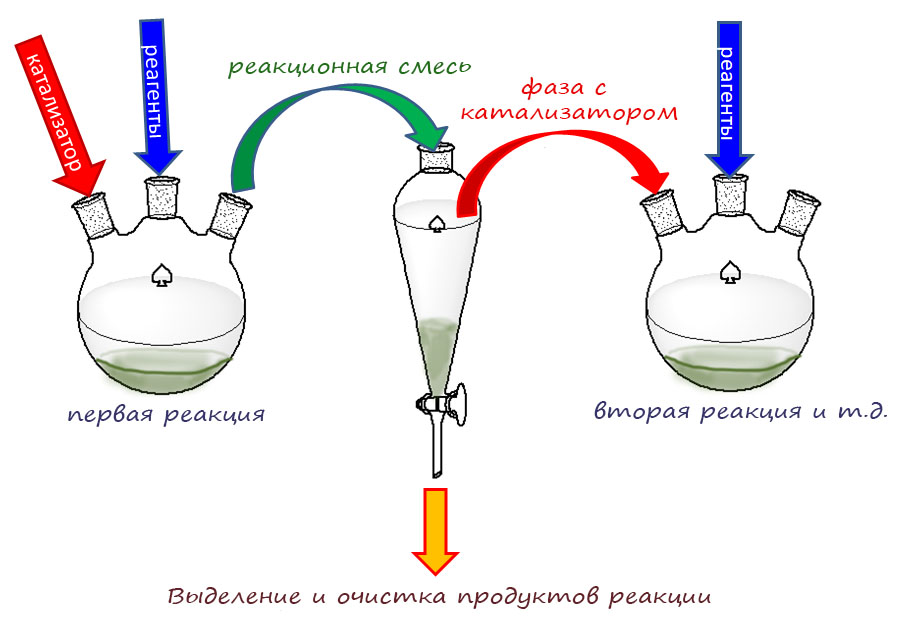
Современная органическая химия устроена так, что разрабатывая новый метод или протокол, исследователи часто имеют в виду не только лабораторное, но и более крупномасштабное применение. В наше время в разных областях используется огромное количество органических соединений, поэтому органический синтез всегда явно или неявно подразумевает возможность масштабирования метода, чтобы получить килограммы или даже тонны желаемого продукта. И когда мы начинаем обдумывать такие перспективы, приходится учитывать и экономические характеристики метода. Получить можно почти любое органическое соединение, но сколько это будет стоить?! И в статье расходов очень серьёзное место всегда будут занимать катализаторы. Поэтому так важны исследования возможности удешевления процесса за счёт более рационального использования катализатора.