Борилирование (кросс-сочетание C-B)
Старые методы получения бороорганических соединений имеют много проблем. Классический метод синтеза борных кислот использует в качестве исходных литий или магний-органические соединения, а следовательно страдает от жестоких ограничений на наличие функциональных групп в ароматическом кольце. Введение в синтез реакции C-B кросс-сочетания драматически расширило диапазон возможных заместителей и сделало реакции борных кислот, в первую очередь кросс-сочетание по Судзуки-Мияуре действительно универсальным методом синтеза.
Каталитическое борилирование
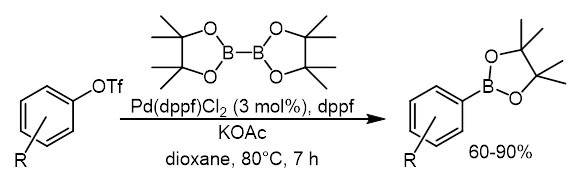
Открыто в 1995-1997 Мияурой с сотр. (J.Org.Chem., 1995, 60, 7508,Tetrahedron lett, 1997, 38, 3447). Типичные электрофилы, ароматические бром и иодпроизводные, а также арилтрифлаты взаимодействуют с производными диборана в присутствии палладиевых катализаторов. Критически важно наличие в реакционной смеси слабого основания, но обязательно такого, где минус расположен на атоме кислорода – ацетата или фенолята. Если взять более сильное основание, получающееся борное производное может сразу вступить в кросс-сочетание с еще непрореагировавшим электрофилом.
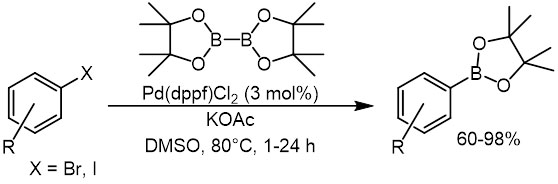
для трифлатов используется почти такая же система.
Почему почти всегда используется такое странное производное бора – эфир гипоборной кислоты с хорошо нам известным по старой органической химии диолом пинаконом (в английском языке он называется не так обескураживающе, как у нас, а именно pinacol, поэтому bis(pinacolato)diboron, сокращенно pinB-Bpin)?
Потому что это самое удобное производное этого типа. Нам ведь нужен реагент для переметаллирования, то есть соединение со связью бор-еще менее электроотрицательный элемент (бор-цинк, бор-олово и т.п.). Все это такая дрянь, что желающих использовать это было бы немного. Остается связь бор-бор, с учетом того, что при переметаллировании из такого соединения половина пойдет на помойку, но выбора все равно нет. Дальше начинается кастинг разных соединений со связью бор-бор, а они, как назло, все либо неустойчивы, либо токсичны. либо труднодоступны. С трудом нашли производные гипоборной кислоты, которые хотя бы более-менее доступны, и с ними можно работать без особых предосторожностей, хотя и без фамильярности – все они очень легко окисляются и воздуха, даже свежего, категорически не переносят. Некоторая дополнительная стабилизация этих эфиров достигается использованием рогатых диолов, которые стерически прикрывают уязвимые атомы бора. Самый доступный из таких диолов как раз и есть пинакон, вот поэтому это производное и стало стандартным реагентом, который можно просто купить в магазине реактивов (вполне доступно – 100 г всего около 1000 евро). К тому же, уже и раньше было известно, что такие пинаконовые эфиры борных кислот, получающиеся в результате борилирования, вполне можно использовать вместо самих борных кислот в реакции Судзуки-Мияуры и в других реакциях. Это важно, потому что гидролиз пинаконовых эфиров до свободных борных кислот – задача очень непростая, и если бы это было бы обязательно нужно, вся затея пошла бы коню под хвост.
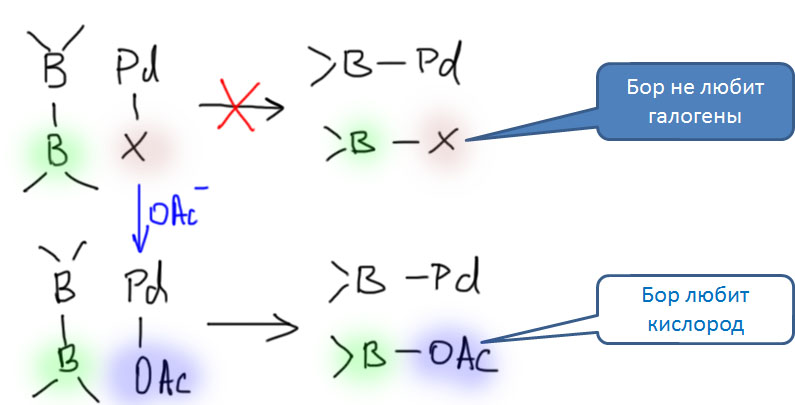
Реакция борилирования – типичная реакция кросс-сочетания, и каталитический цикл состоит из окислительного присоединения, переметаллирования и восстановительного элиминирования, с одним любопытным дополнением. Проблема в том, что переметаллирование идет хорошо, если каждая из сторон, обменивающихся партнерами по связи, получает что-то вкусненькое, кто что любит. Если бы мы исходили из комплекса, получающегося при окислительном присоединении, то второй атом бора получал бы галоген или трифлат. Но бор не любит галогены (кроме фтора, конечно, но фтор сейчас никто не предлагает) – все галогениды (хлориды, бромиды, иодиды) бора весьма реакционноспособны, что свидетельствует о крайней лабильности связей бор-галоген. Трифлат же вообще никто не любит, иначе он не был бы одной из самых лучших уходящих групп – стоит ему куда-нибудь прийти, как он тут же собирается на выход, часто даже не попрощавшись.
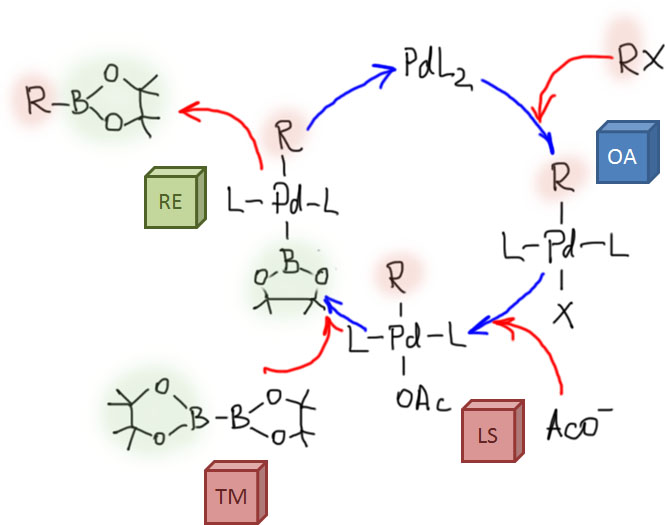
Поэтому нужно было придумать, как обойти эту проблему – вызвать переметаллирование. К счастью, об этом уже задумывались и раньше, и было некоторое понимание того, что бору надо подсунуть кислород. Бор любит кислород довольно сильно, поэтому образование связей бор-кислород выгодно. Дальше начались муки почти адовы – кислородные нуклеофилы почти все являются серьезными основаниями, а это свойство нам не очень подходит, потому что – представим себе на минутку, что вот пошла у нас реакция борилирования, в смеси появилась борная кислота, а там же у нас и палладиевый катализатор и электрофил еще есть, и – тогда образующаяся борная кислота тут же пошла бы дальше в кросс-сочетание по Судзуки-Мияуре и вместо борной кислоты получили бы мы симметричный бифенил.
Подобрали специально такие кислородные лиганды, которые не обладают значительной основностью, и остановились на ацетат- и фенолят-ионах (они похожи, потому что соотвествующие кислоты имеют pK около 5). Чаще берут ацетат. А в каталитический цикл добавилась стадия
Как это часто бывает в химии переходных металлов, в дальнейших исследованиях ассортимент добавок расширился, и появились еще фосфат калия, а потом и вполне сильные основания, и даже одно основание не с кислородом, а с азотом – LiN(SiMe3)2. И никто уже не стал возвращаться и объяснять, отчего это с такими трудами и помпой добытая теория об обязательном замещении лиганда перед переметаллированием на кислородный как-то без лишнего шума перестала быть такой уж обязательной. Я ничего не могу с этим сделать, такова химия, и другой химии у меня для вас нет. Впрочем, если посмотреть на реальные примеры использования реакции борилирования в синтезах, а таких примеров сотни и тысячи, видно, что всё же добавка ацетата калия присутствует в львиной доле, значит она действительно полезна и благотворна, а исключения, как всегда в химии есть, и связаны с какими-то частностями конкретных реакций.
Главным достоинством борилирования является даже не сам синтез большого ассортимента борных кислот, а то, что это метод дает возможность удобно и надежно реализовать вожделенную мечту синтетиков – кросс-сочетание электрофил-электрофил (два разных галогенпроизводных или два разных трифлата или галогенпроизводное-трифлат). Если просто написать такую реакцию, то мы увидим, что для нее потребовался бы восстановитель (потому что слева у нас все нейтральное, а справа получается два минуса на уходящих группах, то есть нужно еще два электрона). Такая реакция заведомо не была бы каталитической, требовала бы еще одного стехиометрического реагента-восстановителя, и порождала бы неразрешимую проблему – образование трех продуктов, так как после восстановления никакой разницы между R и R’ не было бы. Именно поэтому, такую реакцию реально применяют, но именно для восстановительного гомо-сочетания двух одинаковых электрофилов с образованием симметричных бифенилов. Восстановительное кросс-сочетание по определению неселективно, и в синтезе бесполезно.
Выход простой – превратить один из электрофилов в нуклеофил, и применить кросс-сочетание. Борилирование по Мияуре дает шанс реализовать это на практике. Более того, уже в самой первой работе Мияуры с сотр. именно это и было целью исследования.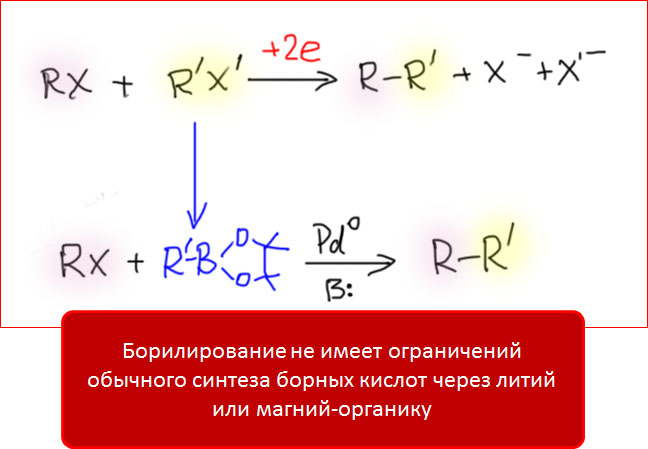
Вот типичный пример из одной из первых работ Мияуры и сотр. Взяли первый трифлат, добавили диборан, катализатор, ацетат калия и растворитель, погрели, покрутили достаточное время для превращения в борат (контролировали расход трифлата по ТСХ), затем просто добавили второй трифлат и основание, подходящее уже для C-C кросс-сочетания (ацетат не годится – слаб, но и не мешает), а катализатор там уже есть, и растворитель годится – погрели и покрутили еще, и продукт кросс-сочетания готов с отличным выходом. Если бы мы выделяли борат и ставили отдельную реакцию кросс-сочетания, выход по двум стадиям точно был бы ниже просто потому, что при выделении бывают потери.
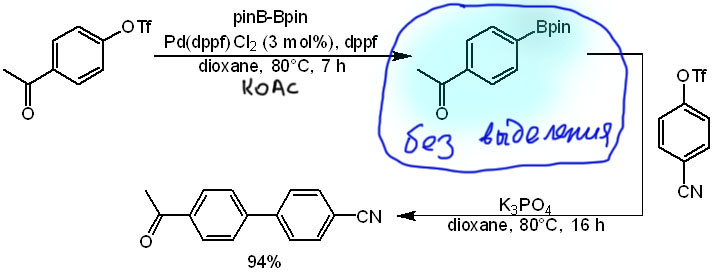
В первой реакции над стрелкой обозначен предкатализатор, комплекс Pd(2+) с dppf, и ещё дополнительно dppf. Зачем? Разве мы не хотим иметь комплекс с одним дифосфином, который, по идее, и так должен получиться из предкатализатора? Да, мы так хотим. Но забываем, что реальные реакции управляются не машиной, а равновесиями и константами скоростей. И ещё мы забываем про неизбежную деградацию лиганда, поэтому катализаторы с точным соотношением Pd:L = 1:1 часто бывают неустойчивы и дают плохие TON. Поэтому дополнительное количество лиганда добавляют нередко. Особенно смешно это бывает в случаях, когда используют модные предкатализаторы, которые по определению должны обеспечивать соотношение 1:1.
Такой режим – выполнение двух или большего количества реакций последовательно, без выделения полупродуктов, в одном реакционном сосуде, – называют по-английски one-pot process, буквально “процесс в одном горшке”. Увы, нормального перевода на русский этот очень популярный термин не имеет, что всегда бывает причиной жутких мучений переводчиков с английского на русский, совершенно искренне ненавидящих это враждебное нашему языку словосочетание.
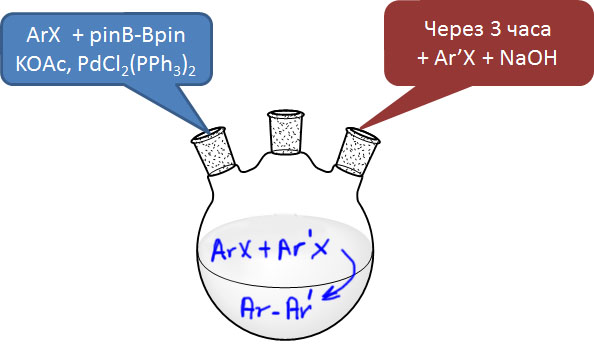
Если бы мы захотели провести то же самое по-старому, получив сначала борную кислоту, то
- во-первых, мы бы не смогли использовать первый трифлат – нет старых способов превращения трифлатов, да и вообще фенолов, в борные кислоты;
- во-вторых, мы бы не смогли взять в первом электрофиле незащищенную функциональную группу, и кетон из примера пришлось бы сначала защитить;
- в-третьих, мы должны были бы сначала отдельно получить Гриньяр или литий-органику, и превратить ее в борную кислоту;
- в-четвертых, мы должны были бы выделить эту борную кислоту, так как реакционная смесь, используемая для получения борной кислоты не годится для кросс-сочетания;
и только потом мы бы сделали кросс-сочетание. По дороге мы бы перепачкали кучу посуды, и неизбежно потеряли бы в суммарном выходе.
Развитие метода
Борилирование – чрезвычайно востребованная в синтезе реакция, поэтому ее быстро и серьезно развивали. Направлений развития было несколько.
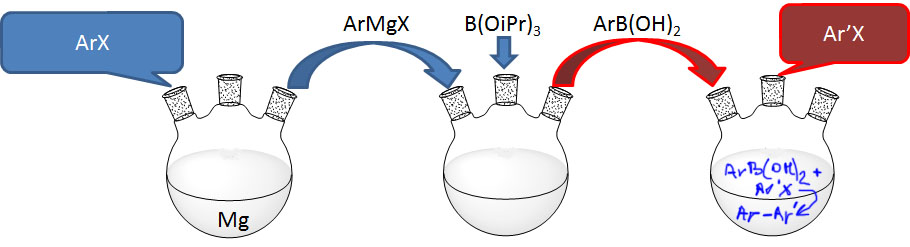
Во-первых, стали использовать хлорпроизводные. Открытия новых сильнодонорных и объемистых лигандов в начале 2000х сделало хлорпроизводные стандартными электрофилами для кросс-сочетания. Борилирование, естественно, не исключение. Протоколы с использованием новых лигандов – XPhos (более универсальный) и SPhos (работает при комнатной температуре, но менее универсален) – разработал сам Бухвальд с сотр.
Во-вторых, старались найти более удачный реагент для борилирования. Бис(пинаколато)дибор хорош всем, кроме одного – для дела из всей массы реагента нужны бор и два атома кислорода, а все остальное идет в отвал. Это не только невыносимо для людей, озабоченных рациональным использованием ресурсов, но и просто дорого. Моль этого реагента стоит почти 2500 евро, и если мы захотим с его помощью получить моль какого-то производного дифенила, то к этим 2500 мы добавим еще цену палладия и лиганда – продукт получится почти буквально “на вес золота”. Не всякая лаборатория сможет это себе позволить. Поэтому, во-первых, стоит поискать реагент полегче.
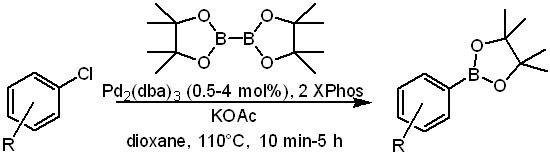
В этом преуспел Г. Моландер с сотрудниками, предложив ту самую кислоту, эфиром которой и является стандартный реагент. Это странное на вид вещество называется гипоборная кислота. Название не должно обольщать – с тривиальной борной кислотой у гипоборной кислоты немного общего. Но она есть в продаже, и хотя 100 грамм ее стоит только на пару сотен евро дешевле 100 грамм ее бис-пинаконового эфира, но молярная масса в три раза меньше, и на моль пойдет уже где-то 700 евро – экономия почти 4-кратная! Ничего не поделаешь, химия стоит дорого, и о таких вещах приходится думать.
Метод Моландера сразу разработан под one-pot кросс-сочетание, и отлично работает для бром и хлорпроизводных, а также трифлатов. Вот пример, показывающий что метод годится для разных функциональных групп в обоих реагентах (Molander et al., 2012, 77, 8678).
Дальнейшее развитие метода: необычные уходящие группы.
Основные электрофилы для любого кросс-сочетания – это бром-производные и трифлаты, они всегда требуют самых простых каталитических систем, доступных лигандов, и дают большие выходы продуктов. Иодпроизводные обычно тоже реакционноспособны, хотя дают выходы пониже, и иногда капризничают. Поскольку они всегда дороже бромпроизводных, никто по этому поводу не убивается. Новые лиганды запустили в дело хлорпроизводные, и если денег на лиганды не жалко, хлорпроизводные в современных протоколах кросс-сочетания регулярно побивают бромиды и трифлаты по выходам продуктов, мягкости условий, и не побоюсь этого страшного слова, толерантности к функциональным группам.
В кросс-сочетании используют и другие уходящие группы. Развитие каталитических систем позволяет включить в ассортимент соединения, которые еще недавно никто бы и не заподозрил в способности участвовать в окислительном присоединении (основная загвоздка почти всегда в этой стадии).
Интересно, что реакция борилирования – одна из самых богатых по возможностям вовлечения необычных электрофилов. Все это – очень свежие исследования, и у них пока нет реальной истории применения в синтезе. Но заявки очень впечатляют.
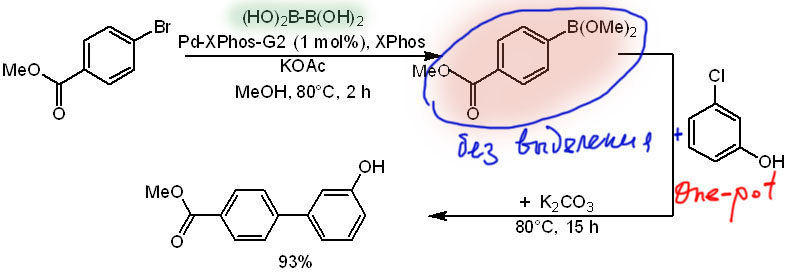
Тозилаты и мезилаты требуют совсем специального лиганда, похожего на o-диалкилфосфинодифенилы Бухвальда, но с заменой второго фенильного кольца на индол (Kwong et al, Chem.Eur.J. 2011, 17, 6913). Тозилаты реагируют шустрее мезилатов, и для них хватает часа-двух, а для мезилатов нужно в тех же условиях от 6 до 24 часов. Набор заместителей типичен для борилирования, но впервые появляется еще и свободная амино-группа.
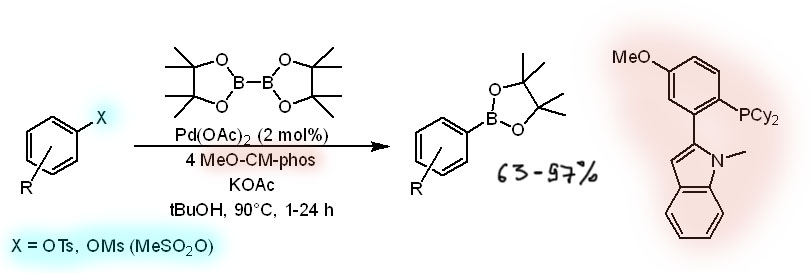
Но совсем недавно был описан гораздо более простой никель-катализируемый протокол борилирования тозилатов и мезилатов с простым лигандом и очень мягкими условиями.
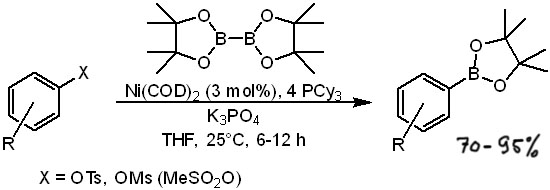
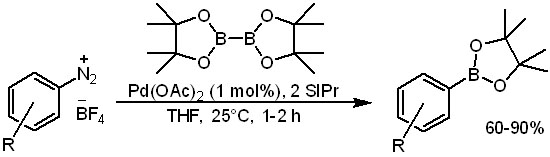
Из соединений со связями C-N также можно получить боронаты каталитическим борилированием. Использование ароматических нитро-соединений в этих реакциях не описано, вероятно, потому что окислительное присоединение по связи C-N в нитро-соединениях невозможно из-за того, что соседние связи N-O/N=O намного более склонны принимать лишние электроны от донорного атома металла, и разрыхляющая орбиталь, обслуживающая связь C-N всегда будет значительно выше по энергии. При этом нитро-группы всегда легко восстановить, а борилирование солей диазония и даже прямо ароматических аминов хорошо известно и описано. Соли диазония вступают в реакцию в очень мягких условиях (а жестких они бы и не выдержали), но требуют карбенового лиганда, а функциональные группы в ароматическом кольце в этом случае, скорее, ограничивается возможностями получения самих диазониевых солей.
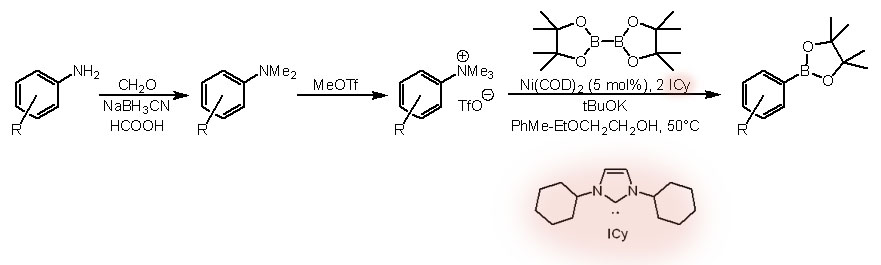
Ароматические амины (анилины) нужно сначала превратить в четвертичные соли аммония (Shi et al, J.Org.Chem., 2016, 81, 14)), что очень просто делается действием чрезвычайно активного SN2-метилирующего агента метилтрифлата, а затем воспользоваться способностью Ni(0) окислительно присоединять самые разные связи, в том чисте и C-N. Протокол использует карбеновый лиганд. Он совместим с самыми разными функциональными группами, включая свободную амино-группу и карбоксил.
дальше идут всякие сернистые остатки. даже такие необычные как сульфоксиды (Ёримицу и сотр., Synthesis, 2017, 49, 4769), которые отдают обе арильные группы, хотя и требуют нетривиального основания и мощного лиганда.
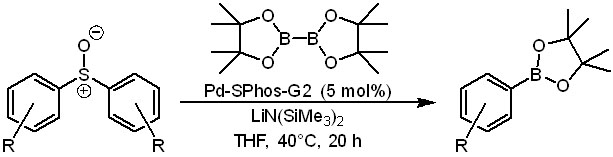
Из новейших расширений метода очень интересна работа Ёримицу и сотр. (ACS Catal., 2018, 8, 579) о борилировании сульфониевых солей, которые получаются прямо на месте реакцией кватернизации сульфидов с метилтрифлатом. Борилирование требует использования новых высокоэффективных лигандов типа XPhos. Но реакция идет в очень мягких условиях и отлично работает при самых разных заместителях в кольце, включая незащищенные OH и COOH-группы.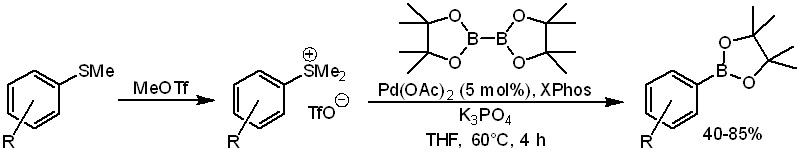
В конце приведем примеры использования реакции борилирования в реальных синтезах из оригинальной научной литературы
пример кросс-сочетания в синтезе новых антибиотиков
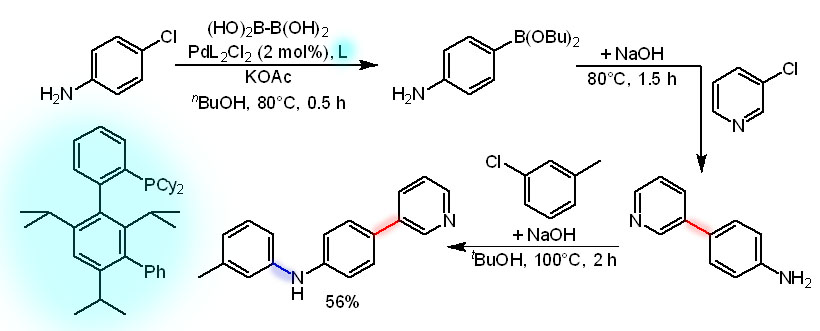
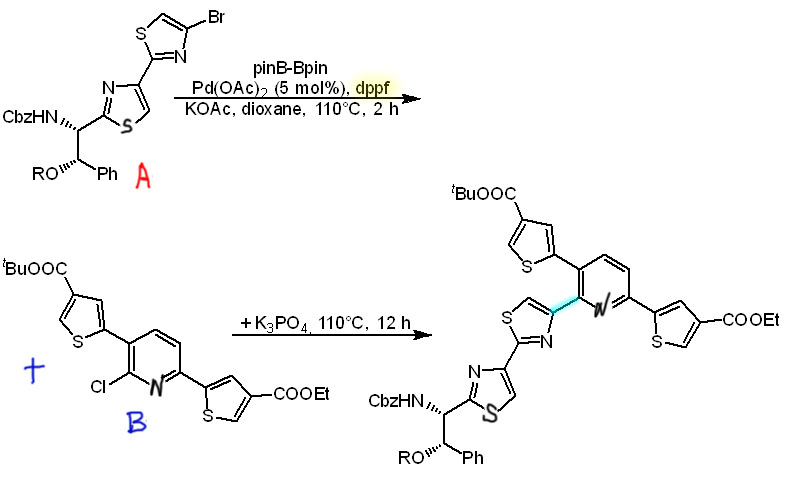
Пример one-pot борилирования и C-C кросс-сочетания в синтезе синтетического аналога амитиамицинового антибиотика (Org.Biomol.Chem., 2018, 16, 526), когда в одну молекулу собирают два уже крупных фрагмента, подготовленных в отдельных синтезах. Молекулу A сначала борилируют, затем в том же горшке сочетают с молекулой B, только добавив основание для реакции Судзуки-Мияуры. Обратите внимание на то, что хлорпроизводное нормально сочетается с использованием обычного лиганда dppf. Попробуйте разобраться, почему эта реакция идет достаточно легко, в то время как для хлорпроизводных, как правило, требуются особые сильнодонорные и объемистые лиганды.
пример 2: новый протокол борилирования - кросс-сочетания с sp3-электрофилом
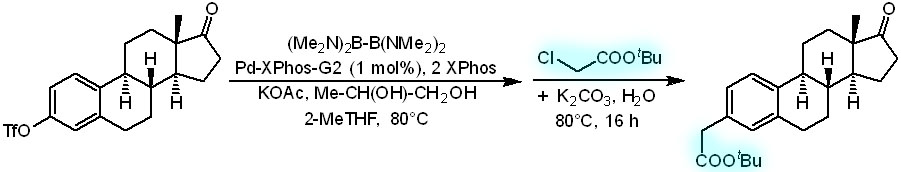
Протоколы для борилирования-кросс-сочетания в одном горшке, которые мы рассмотрели, хорошо работают, когда нужно соединить два ароматических фрагмента. Но для соединения ароматического фрагмента и алкильного электрофила пришлось разработать новый протокол с использованием еще одного производного диборана, на этот раз амида гипоборной кислоты (Pulis et al, Chem.Comm., 2017, 53, 9364). Протокол при этом сильно похож на метод Моландера для самой гипоборной кислоты, но с несколькими отличиями. 2-метилтетрагидрофуран вместо обычного ТГФ взяли больше для зеленого выпендрежа – этот модный растворитель делают из соломы и семечковой шелухи. А вот для чего там пропиленгликоль попробуйте догадаться сами. Присылайте ваши предположения на известный адрес. Вот как новый протокол применили для модификации стероида (выход 93%).
пример 3: использование борилирования для сочетания одинаковых фрагментов
Метод борилирования – кросс-сочетания в одном горшке можно использовать и для гомо-сочетания. Мы это уже обсуждали, когда разбирались в условиях для борилирования и подбирали основание так, чтобы переметаллирование облегчить, а реакцию Судзуки не инициировать, и тогда мы как раз боялись гомо-сочетания, как побочной реакции. Но если нам нужен как раз продукт соединения одинаковых фрагментов, разумно половину исходного субстрата превратить в боронат, а потом добавить вторую половину и основание. Если лень так сильно утруждаться, можно просто сразу добавить вместо ацетата основание, годное для Судзуки, и положиться на благосклонность богов, отвечающих за реакционную способность. Но безсмертныя боги редко бывают благосклонны к смертным лодырям.
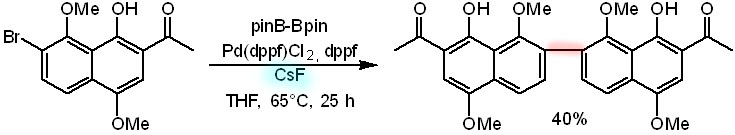
Вот пример применения этого подхода для синтеза природных метаболитов бис-нафтохинонового ряда (Eur.J.Org.Chem., 2016, 5778) – в них всегда две половинки одинаковые. Видим, что просто сразу добавили фторид цезия, весьма популярное основание для Судзуки-Мияуры, и пролучили весьма скромный выход. Это все потому, что высокий выход получился бы, если скорость борилирования была бы намного меньше скорости кросс-сочетания, и тогда каждая молекула продукта борилирования находила бы себе пару для сочетания. Видимо, не повезло, и борилирование было быстрее Судзуки. А почему фторид работает в кросс-сочетании как основание, и почему обязательно цезия, разберемся в своем месте.
пример 4: три реакции в одном горшке - C-B, C-C и С-N кросс-сочетание
Использование современных специальных лигандов делает возможным совмещать в одном горшке и еще больше реакций. Вот пример соединения борилирования, реакции Судзуки-Мияуры и C-N кросс-сочетания. Авторам работы пришлось немного поработать над лигандом, так как известные лиганды не давали хороших выходов конечного продукта. Небольшая модификация лиганда Xphos всего-навсего одной фенильной группой дала новый лиганд, который оказался эффективен для всех трех кросс-сочетаний, приходилось только добавлять следующие компоненты, немного соответствующего стадии основания (едкий натр вполне годится и для Судзуки и для аминирования с такими лигандами) и растворителя (для аминирования с современными лигандами хорош трет-бутанол).