Более сложные лиганды: дентатность и хелатирование
Несколько простых лигандов можно связать веревочкой в одну молекулу. Слово “веревочка” здесь вполне уместно – по-английски это называется tether, то есть буквально привязь, поводок, веревочка, на которую привязывают козу или иное существо, чтобы не убежало и было рядом. Аллюзия, конечно, малость кривая, потому что две козы или три козы, или козу и собаку, или козу, белую мышь и слона на одну веревочку не привязывают, хотя именно это часто и делают в координационной химии – связывают в одну молекулу одинаковые или разные – иногда очень разные – координационные центры. И верёвочки далеко не всегда бывают гибкие, довольно часто координационные центры жестко монтируют в большую, например, ароматическую молекулу. Количество координационных центров называется дентатностью (т.е. зубастостью, если принять метафору, что лиганд вцепляется в металл зубами), а лиганды, соответственно, бывают бидентатные, тридентатные, тетра-, пента- и т.п. – полидентатные. Этилендиамин, фенантролин, 8-гидроксихинолин – бидентатные лиганды, хорошо всем известный комплексон III – гексадентатный, и т.п. Каждый центр полидентатного лиганда можно определить как независимый лиганд L- или X-типа, сравнив с аналогами – простыми лигандами.

Особенно интересен и важен случай, когда при образовании комплекса координационные центры полидентатного лиганда связываются с одним металлом – образуется циклический комплекс. Такие комплексы принято называть хелатами, опять с помощью аллюзии из мира животных, но в этом случае каждый координационный центр сравнивают с клешней рака или краба, приписывая этим существам привычку хвататься за пищу сразу обеими клешнями. Ну нет у них такой привычки – отлично справляются и одной клешней, но координационным химикам если уж что приснится, то спорить бесполезно.
Самые желанные циклы вроде бы такие же, как и в органической химии – пяти и шестичленные, именно с расчетом на такие циклы проектировали большинство хелатирующих лигандов. Почему 5- или 6-членные? – вовсе не потому, что они якобы самые устойчивые, а потому, что это компромисс, золотая середина, между энергией и энтропией. Для образования меньших циклов приходится сгибать связи за пределы нормальных валентных углов, а это невыгодно (энергия), а для больших циклов быстро уменьшается вероятность образования цикла – чем длиннее цепь, связывающая центры, тем реже сближаются реакционные центры. Тем больше степеней свободы теряет лиганд при связывании в цикл, а это отрицательный вклад в энтропию, и чем больше степеней свободы потеряно, тем больший.
Но – и это очень важно – в органической химии превосходство 5 и 6-членных циклов выражено очень явно и бесспорно; уже 7-членные циклы хоть и получаются в тех же реакциях, но выходы редко превышают 20-30%, а у больших циклов и 1-2% часто считаются прекрасным результатом. С другой стороны 4-членный цикл даже ещё более ненавистен: большинство реакций, ведущих к образованию такого цикла, имеют фотохимическую природу – в возбуждённом состоянии молекулы, как и другие объекты Природы, часто ведут себя довольно странно, хватаются за что ни попадя, часто пренебрегая и напряжением, и стерикой, и обычными для себя невозбуждённых свойствами и реакционной способностью.
Но в комплексообразовании немного другие закономерности, из-за чего золотое правило циклизации – пять или шесть – оказывается не таким однозначным. Это связано и с иной стереохимией переходных металлов и наличием у них более разнообразных стереохимических конфигураций, и с гораздо большей пространственной протяжённостью d-орбиталей, что позволяет связям образовываться при гораздо больших межатомных расстояниях. Кроме того, в хелатировании комплексов переходных металлов при образовании хелатного цикла связи металл-лигандный центр образуются не одномоментно, а последовательно, и связываемая гибкая молекула лиганда теряет много степеней свободы не сразу, а понемногу на каждой стадии.
Поэтому образование больших хелатных циклов, и семи- и восьмичленных, и ещё больших гораздо более распространено. На таких хелатах строится современный дизайн катализаторов, и мы это увидим, когда доберёмся до конкретных методов. Можно даже сказать так: обычные хелаты (5 и 6-членные) обычно играют чисто вспомогательную, служебную роль (стабилизируют металл в нужной степени окисления, защищают координационную сферу от непрошенных гостей, повышают растворимость комплексов и т.п.). В то же время, у необычных хелатов чаще бывает более существенная роль, они настраивают механизм каталитической реакции, определяют селективность и реакционную способность, делают возможным то, что было без них невозможно. Увидим много таких примеров.
Бывают и малые хелатные кольца – четырёхчленные, и нередко. И у них тоже своя роль.
А вот с трёхчленными циклами проблема. Нарисовать такие легко, но при определении того, как реально связан такой лиганд с металлом возникает вопрос, два ли там лигандных центра, или один дигапто-типа (об этом ниже). Вернёмся к этой проблеме, когда разберёмся с гапто-лигандами.
Определение структурного типа комплекса, и других параметров для хелатных комплексов делают точно так же, как для обычных. (A.Fuyuhiro, et al Chem.Lett. (1991), 1041)
(A.Fuyuhiro, et al Chem.Lett. (1991), 1041)
Каждый координационный центр считают отдельно, определяют типы лигандов, а дальше все как обычно. Хелатных циклов может быть несколько. Самый, наверное, знаменитый из хелатирующих лигандов – этилендиаминтетраацетат (ЭДТА, комплексон III, трилон Б) образует до пяти пятичленных хелатных циклов на одном металле, но никаких проблем в определении координационного окружения металла и всех его параметров нет.
(И.Н.Полякова и др, Кристаллография (2000), 45, 41)
Шестичленные хелатные циклы, например, образуют очень широко распространенные лиганды – дикетонаты. С самым распространенным дикетонатом – ацетилацетонатом (сокращается смешно: acac) знакомы все. Комплекс образуется енольной формой, один кислород поэтому связан как X-лиганд, второй как L-лиганд.

Структура (F.Huq, A.C.Skapski, J.Cryst.Mol.Struct. (1974), 4, 411)
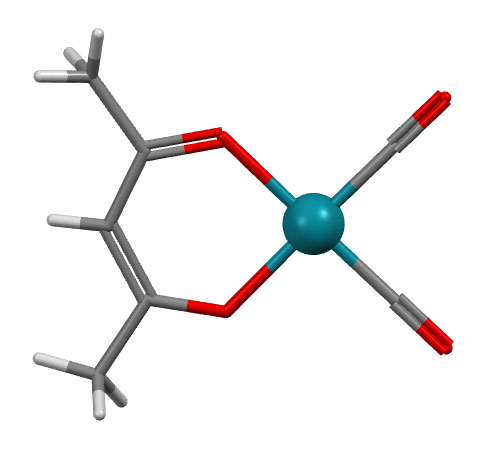
Хелатные циклы бывают и других размеров, и четырех, и семичленные (больше совсем уже редко). Четырехчленный хелатный цикл очень часто образуют ионы карбоновых кислот и карбонат-ион, но не только. Конечно, количество комплексов с четырёхчленным циклом на порядки меньше, чем 5- и 6-членных хелатов, но их нельзя считать экзотикой: четырёхчленный хелатный цикл довольно широко распространён, и легко образуется. Вполне понятно почему. На стереохимию переходных металлов нельзя просто так переносить закономерности стереохимии углерода и других неметаллов. У углерода нет стереохимических конфигураций с валентными углами близкими к 90 градусов, поэтому такой валентный угол для углерода невыгоден и ведёт к значительному угловому напряжению. Но у переходных металлов таких конфигураций очень много – это октаэдр и всё, что из него получается сокращением числа лигандов (пирамида, плоский квадрат, уголок), а значит, и никаких напряжений при образовании таких циклов нет.

Бидентатные фосфины
Фосфины играют совершенно колоссальную роль в химии поздних переходных металлов – это, без сомнения, важнейший и совершенно незаменимый класс лигандов. Понятно, что и среди хелаторов фосфины должны быть обильно представлены. Когда мы будем разбираться с конкретными реакциями, увидим много специальных лигандов новых поколений, играющих ключевые роли в определённых реакциях. Но в самом начале этой химии фантазия не ушла дальше ближайших родственников трифенилфосфина, которые получились сшивкой дифенилфосфиновых фрагментов на алкильном линкере. Так получилось четыре классических лиганда, известных всем, кто занимается каталитической химией, потому что они до сих пор не утратили значения, и с них обычно начинают исследование новых каталитических систем, нуждающихся в хелатном окружении металла. Они доступны, недороги, и обладают очень важным качеством – имея все четыре под рукой, исследователь может быстро определить, насколько важным для его реакции является размер хелатного цикла, и стоит ли предпрингимать усилия по поиску более изощрённых лигандов-хелаторов. Эта четвёрка имеет всем известные сокращения dppm, dppe, dppp, dppb. Я предпочитаю маленькие буквы, другие же больше любят большие. Никаких стандартов на это нет.
Самый маленький из этих фосфинов – бис(дифенилфосфино)метан или dppm образует комплексы с четырёхчленным хелатным кольцом, как, например, в этом комплексе рутения (Chen Y et al. Chem.Asian J. (2011), 6, 2000)
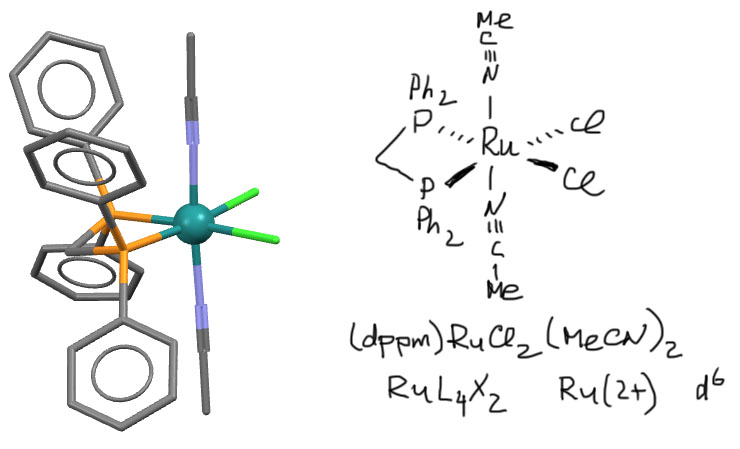 Как мы уже выяснили, для переходных металлов четырёхчленный цикл не представляет никаких проблем, но всё же он не так выгоден, как 5- и 6-членные. Поэтому хелаторы с 4-членными циклами всё же чаще предпочитают не образовывать цикл, а работать как мостики или даже просто монодентатные лиганды. Во втором случае есть возможность использовать временно свободный координационный центр для связывания, например, другого металла. Если хотите посмотреть примеры, как dppm может образовать комплексы разных типов .
Как мы уже выяснили, для переходных металлов четырёхчленный цикл не представляет никаких проблем, но всё же он не так выгоден, как 5- и 6-членные. Поэтому хелаторы с 4-членными циклами всё же чаще предпочитают не образовывать цикл, а работать как мостики или даже просто монодентатные лиганды. Во втором случае есть возможность использовать временно свободный координационный центр для связывания, например, другого металла. Если хотите посмотреть примеры, как dppm может образовать комплексы разных типов .
Самый популярный фосфин этого ряда – пятичленный хелатор бис(дифенилфосфино)этан, dppe. С ним одним получено больше комплексов, чем со всеми остальными тремя. Это неудивительно – пятичленный цикл везде самый распространённый и самый выгодный по балансу энергия/энтропия. С этим лигандом другие типы связывания встречаются редко.

(B.P.Cleary, R.Eisenberg, Organometallics 1992, 11, 2335)
Шестичленный хелатор бис(дифенилфосфино)пропан dppp несколько менее популярен. На типичной структуре хорошо видно, что хелатный цикл неплоский и имеет типичную конформацию кресла (точнее, полукресла, больше похожего на форму циклогексанона, чем самого циклогексана.

(F.Caruso et al., J.Med.Chem. 2003, 46, 1737)
Самый большой из этого ряда и самый редкий, бис(дифенилфосфино)бутан или dppb может образовывать семичленные хелаты, как в представленном гидриде рения (D.M.Kimari, et al. Inorg.Chem.Commun. 2005, 8, 14), но в таких циклах уже начинает проявляться проблема с энтропийной невыгодностью замыкания циклов более 6-членных, поэтому таких комплеков уже немного, а dppb чаще работает как мостиковый лиганд, связывающий два металла.
Бидентатные и полидентатные лиганды не обязательно образуют хелаты
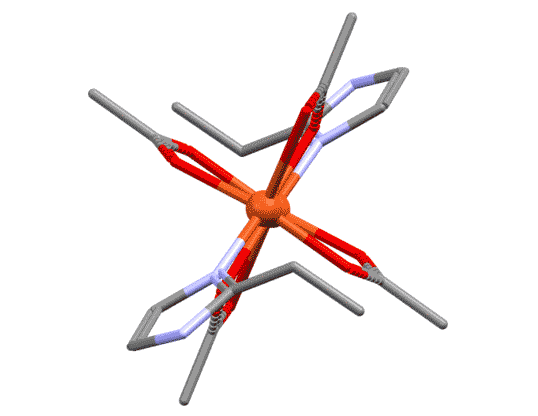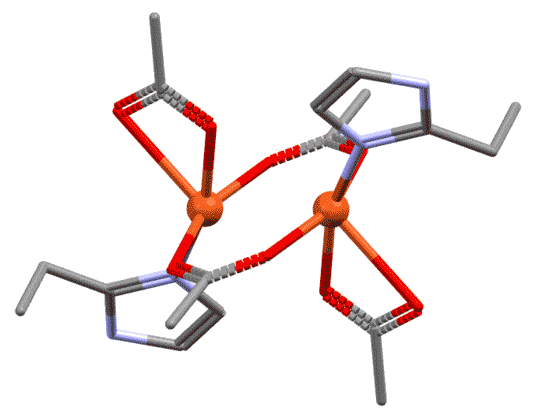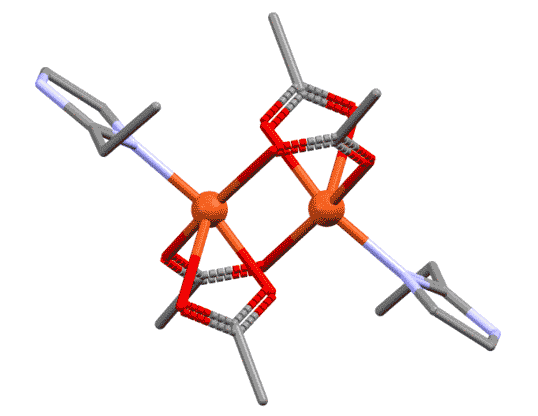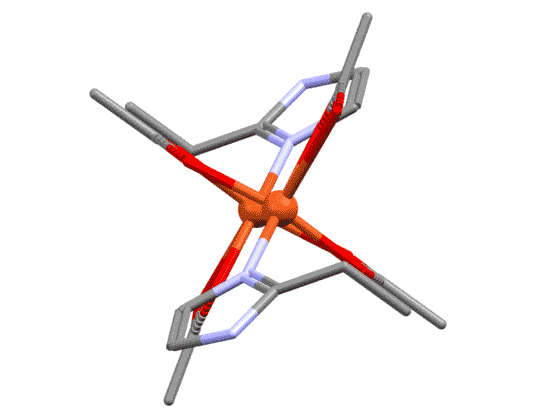
Би- и полидентатные лиганды с несколькими координационными центрами могут связываться не с одним металлом, а сразу с несколькими, образуя мостики между атомами металла. Тогда их так и называют “мостиковыми” или μ-лигандами. Причины, по которым один и тот же лиганд в одном случае работает как хелатор, а в другом – как мю-лиганд, могут быть самыми разнообразными. Иногда у металла не хватает места в координационной сфере для хелатного связывания. Другая причина – просто оптимизация взаимодействий. Например, если хелатный цикл неоптимального размера, то может быть более выгодно образовать мостик, чем хелат. Это особенно характерно для 4-членных хелатов, которые имеют нектороые проблемы с напряжением (не такие, как в обычной органической химии). Ацетат-ион и другие подобные лиганды в этом смысле очень показательны: есть тысячи комплексов с хелатным ацетатом, и не меньше – с мостиковым. А вот забавный пример смешанного комплекса меди, где есть и хелатный и мостиковый ацетат (J.Hernandez et al., Synth.React.Inorg.,Met.-Org.,Nano-Met.Chem. 2015, 45, 342, ccdc ref: POMJIM). Если его покрутить, это особенно хорошо видно. 
Разглядывая этот двухядерный комплекс, мы можем поупражняться в обычных подсчётах электронов. Каждый атом металла ведёт себя как независимый координационный центр, и мы его оцениваем отдельно. В данном случае оба центра одинаковы, поэтому запишем для любого из них. Мостиковый лиганд мы оцениваем точно так же, как обычный хелатирующий – в данном случае у него два центра, один X-типа, другой L-типа. И если на одном атоме лиганд преоставляет оба типа, то в мостиковом варианте два таких лиганда как бы меняются ролями, уравнивая окружение у каждого атома. Если бы у нас был один мостиковый лиганд такого типа, то центры не смогли бы стать одинаковыми – один получил бы X-конец, второй – L. Слава всем заинтересованным богам, у нас их два. Получаем, что каждый атом меди имеет координационное число 5, степень окисления +2.
Мостиковые лиганды не обязательно являются бидентатными или полидентатными
Для того, чтобы служить мостиком, лиганд не обязательно должен быть настоящим би- или полидентатным. Но обязательно должен иметь минимум два места связывания с атомом металла. Это может быть всё, что угодно – переходные металлы исключительно изобретательны и иногда находят в самых незатейливых молекулах возможности, о которых те и не подозревали. Как минимум, это, например, две неподелённые пары, а это есть, например, у атомов галогенов или кислорода, и поэтому галогениды, вода, гидроксид, алкоксиды и прочее весьма неплохо играют роль мостиков в миллионах координационных соединений.
Когда мы рассматриваем такие комплексы, есть небольшая сложность в том, как учитывать мостиковые лиганды. Общая рекомендация проста – нужно внимательно относиться к валентным возможностям каждого. Фокус здесь в том, что по отношению к связанным мостиком металлу мостиковый лиганд симметричен, каждый металл видит его совершенно одинаково. Но для анализа структуры приходится формально разделить функции. Самый простой и распространённый случай, как в приведённом комплексе. Оба атома металла одинаковы, имеют один и тот же структурный тип. Хлоридный лиганд образует мостик, но до образования мостика он сидел на одном атоме металла хлоридом, то есть X-лигандом. При образовании мостика степень окисления не меняется, поэтому для второго атома металла он стал L-лигандом. Поскольку таких мостика два, второй мы учтём точно так же, но в другом порядке. Это и даст нам симметричное окружение металла. Если металлы в многоядерном комплексе одинаковы, достаточно указать общий структурный тип. Если разные, а так бывает очень часто, то каждый металл должен быть охарактеризован отдельно.

(Jin X, et al., Chin.Sci.Bull. 1983, 28, 1334, ccdc ref: BUBYIG)
Разберитесь в структуре приведённых комплексов, определите тип лигандов, структурный тип, степень окисления и число d-электронов металла (по 3 плюсика за верный разбор каждого). Если ещё посчитаете число валентных электронов, то ещё по два плюсика.
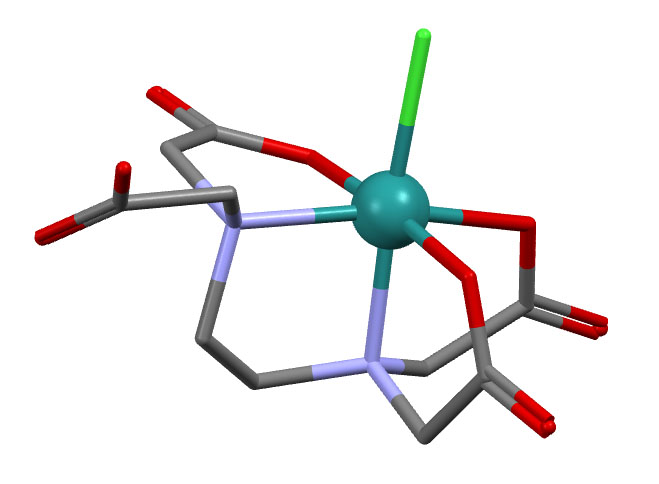
NH4[RuCl(edta-H)]
Эту структуру не так просто разобрать, поэтому не торопитесь. В комплексах ЭДТА (напмню, что ЭДТА это этилендиаминтетраацетат – то есть тетраанион, но далеко не всегда в комплексах он связывается всеми четырьма ацетатными группами, одна или больше могут оказаться не у дел, и тогда вам придется решить, в каком они виде – анионном или сопряженной кислоты, а от этого зависит заряд всего комплекса и где этот заряд находится. Поскольку на рентгене водороды не видны (их рисуют произвольно, и поэтому проще их опустить), то структура не говорит нам где они.
В качестве подсказки, которая поможет правильно понять эту структуру, приведу способ получения комплекса: его получили длительным нагреванием смеси гидрата RuCl3, диамида этилендиаминтетрауксусной кислоты в растворе разбавленной HCl – кристаллы вываливаются из раствора после охлаждения.

trien – это тетраамин, тример этилендиамина в том же смысле, как триэтиленгликоль – тример этиленгликоля. Комплекс выделен в виде соли, гидрокарбоната.
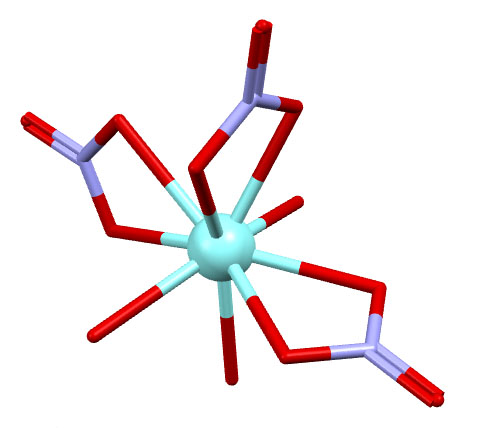
(dppb)Ru(bipy)(CO3)


LIXKIM: J.Jolley, C.J.Campbell, A.Castineiras, A.I.Yanovsky, K.B.Nolan, Polyhedron (1999), 18, 49, doi:10.1016/S0277-5387(98)00266-6
OGIHOB: R.Wen, I.Bernal, J.Coord.Chem. (2000), 52, 15
LEYJAA: R.D.Rogers, A.N.Rollins, J.Chem.Cryst. (1994), 24, 321, doi:10.1007/BF01670208
CISTEG: C.P.Popolin et al., PLOS One, 2017, 12, e0183275
COVDEW: F.H.Moore, B.H.O’Connor, B.T.M.Willis, D.C.Hodgkin, Proc.Indian Acad.Sci.,Chem.Sci. (1984), 93, 235



