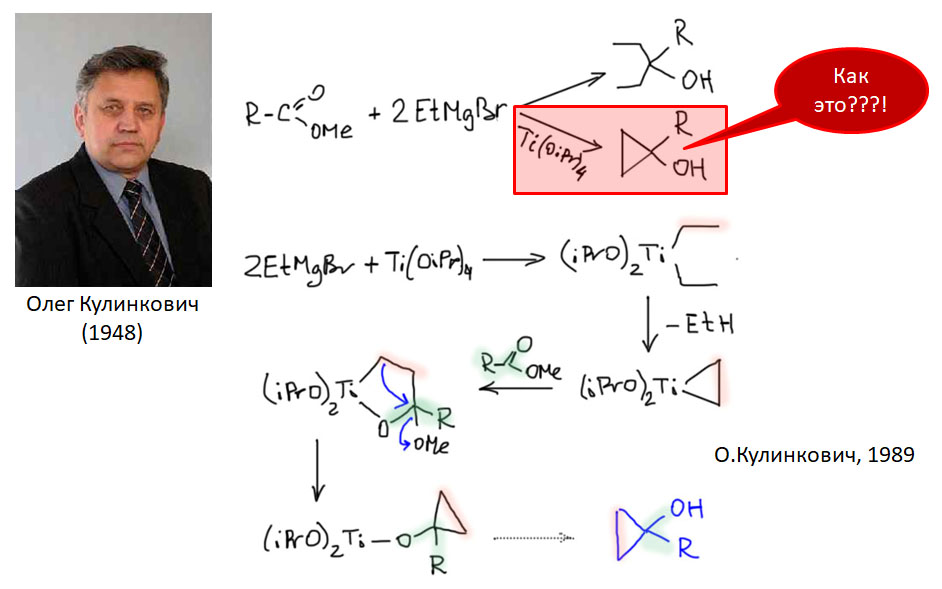
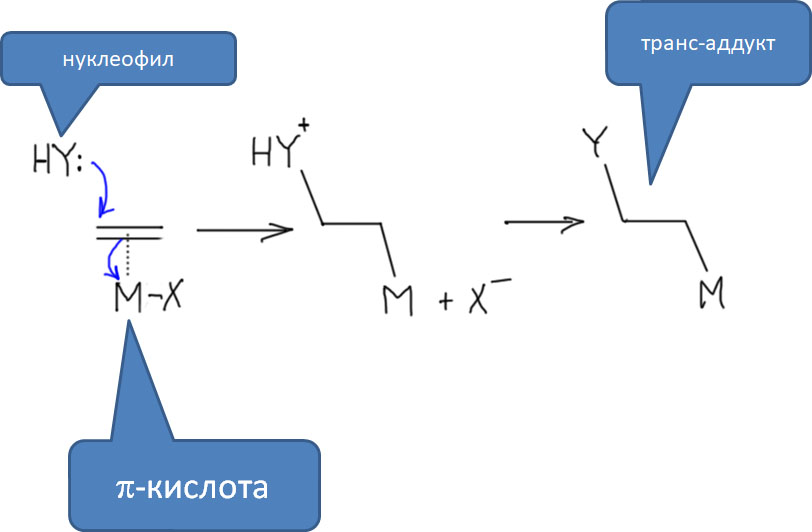
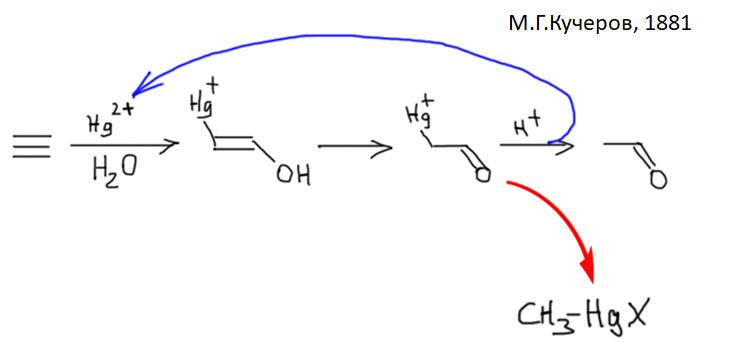
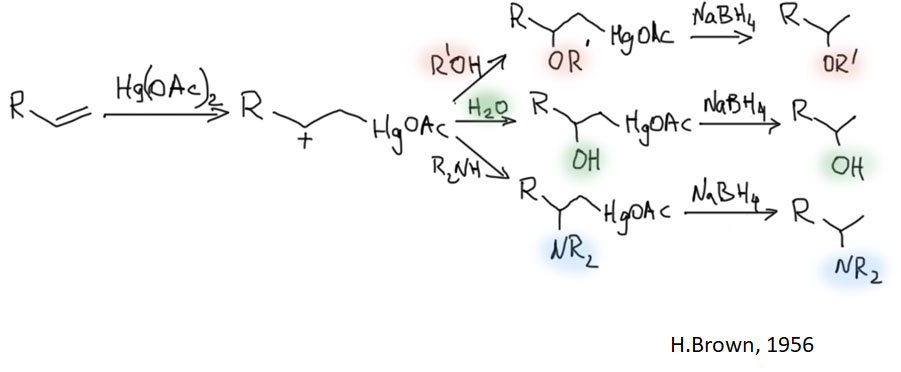
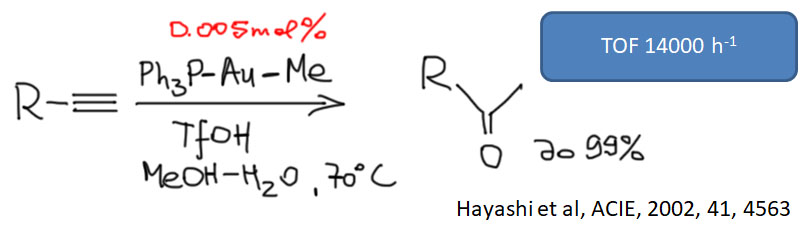
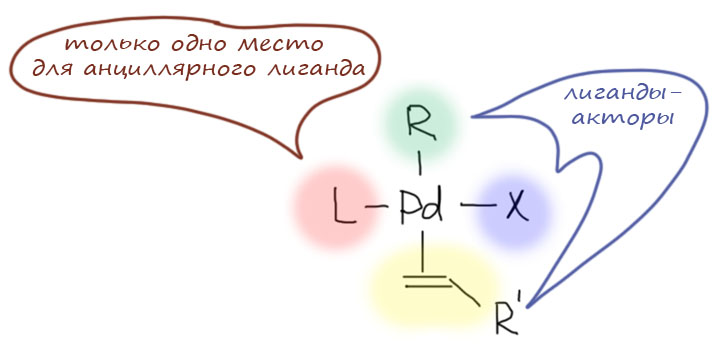
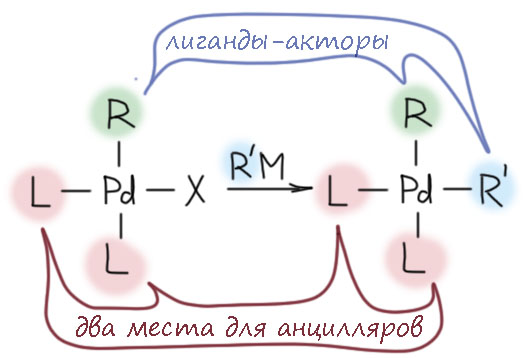
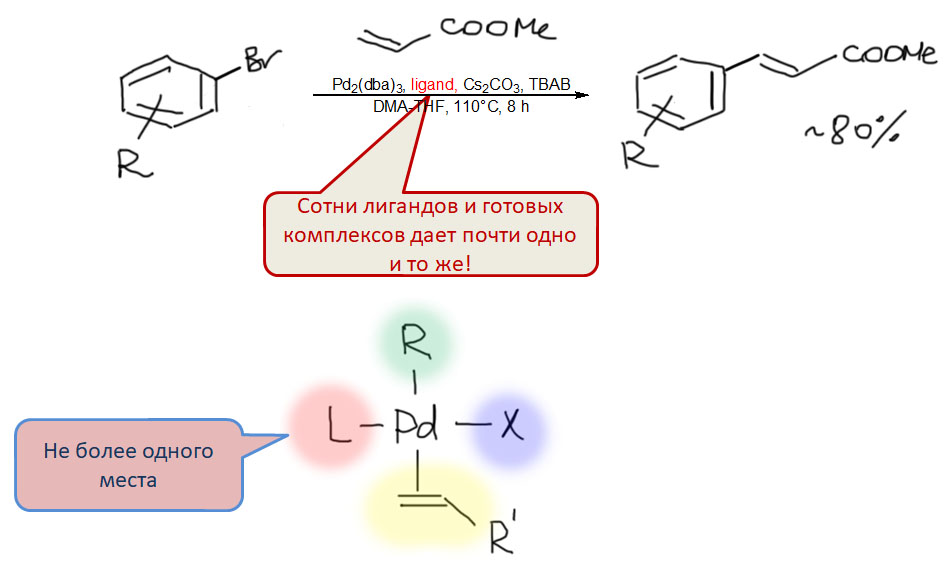
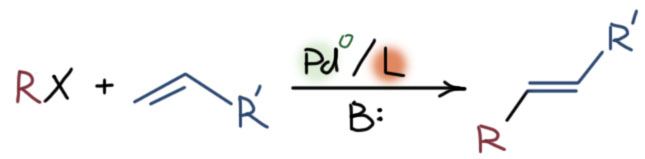Олефины и ацетилены
Соединения с кратными углерод-углеродными связями являются одними из важнейших субстратов для реакций с участием комплексов переходных металлов. Количество таких реакций огромно и регулярно увеличивается. Изучение таких процессов – один из самых живых разделов органической химии. Среди реакций олефинов и ацетиленов очень много процессов промышленного значения, и не только в тонком органическом синтезе современных лекарственных препаратов и новых материалов, но и в крупнотоннажном синтезе полупродуктов, а также в полимеризации – в современной промышленности полимеров производство полимеров молекул с двойной связью (полиолефинов) с использованием комплексов переходных металлов в качестве катализаторов полимеризации. Как и в смежных областях химии комплексов переходных металлов в органическом синтезе, в последние 20 лет наблюдается бурный прогресс, связанный с качественным скачком в понимании закономерностей реакционной способности координационных соединений и рационального дизайна лигандов и реагентов новых типов.
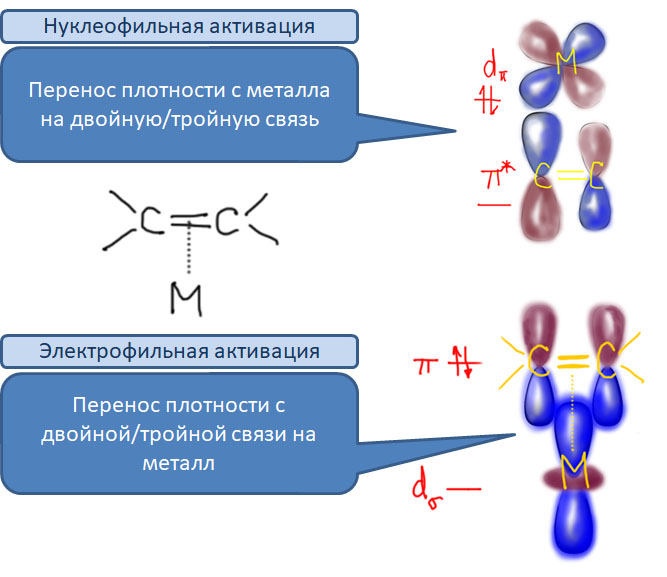
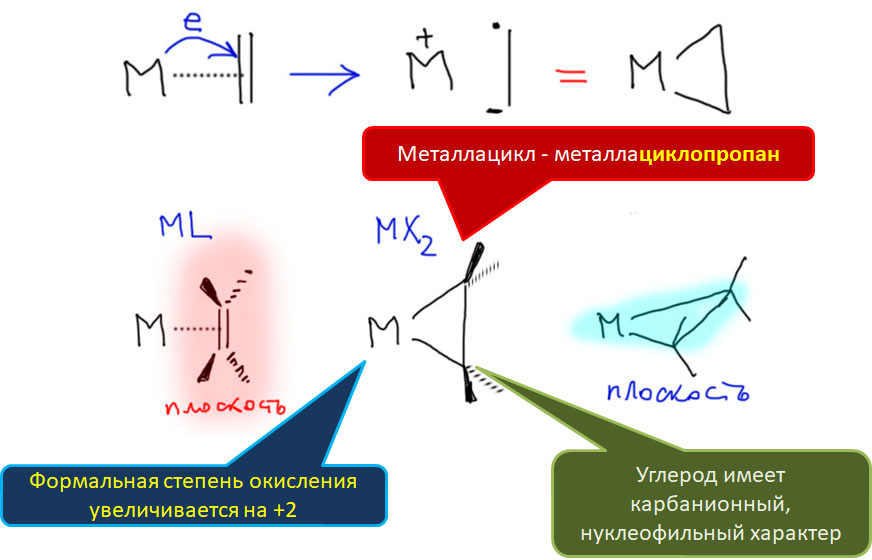
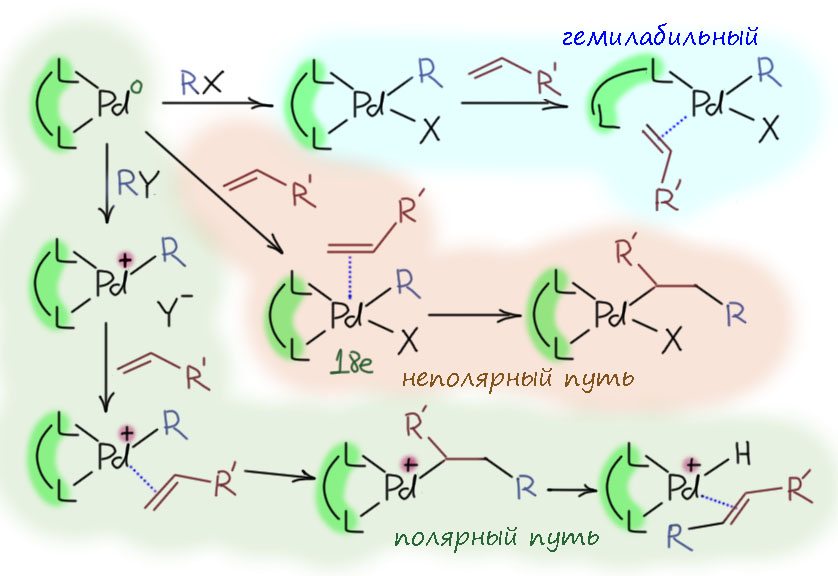
Реакционная способность олефинов и ацетиленов после вхождения в координационную сферу металла определяется тонким балансом двух взаимодействий – прямой координационной связи и эффекта обратного донорного взаимодействия, отвечающие за противоположные направления смещения электронной плотности – от лиганда на металл и от металла на лиганд. Сначала посмотрим на два крайних случая, когда преобладает одно из взаимодействий. Преобладание обратного донорного эффекта (back-donation) сообщает координированному олефину свойства нуклеофила, а каждый из двух атомов углерода связи становится похож на карбанион.
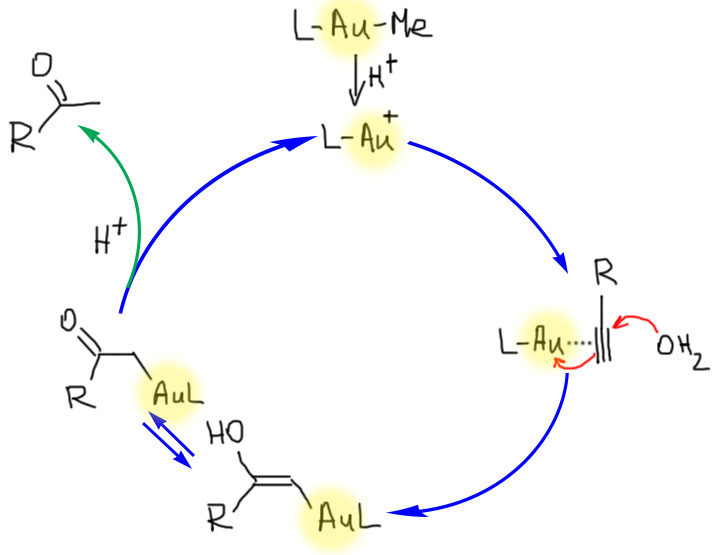
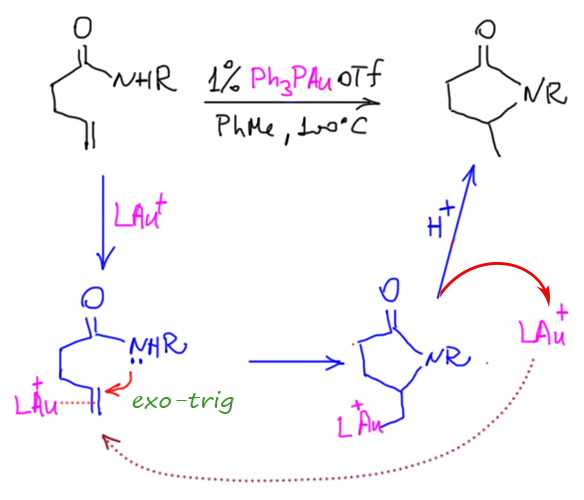
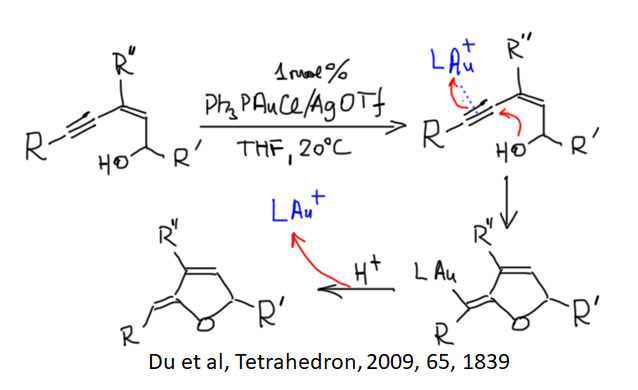
Электрофильная активация кратных связей не менее важна и лежит в основе многих важных процессов, так как такая активация приводит к тому, что к активированным кратным связям присоединяются даже слабые нуклеофилы. Дальнейшее развитие сюжета зависит от металла и от способа выхода сигма-связанного органического лиганда, образовавшегося в результате такого присоединения, из координационной сферы металла.
Донорный и акцепторный компоненты связи металл-двойная или тройная связь гораздо чаще не преобладают друг над другом, как в двух уже рассмотренных типах процессов, а находятся в тонком балансе, и в этом случае невозможно точно сказать, нуклеофильной или электрофильной является активация двойной или тройной связи, вошедшей в координационную сферу металла.
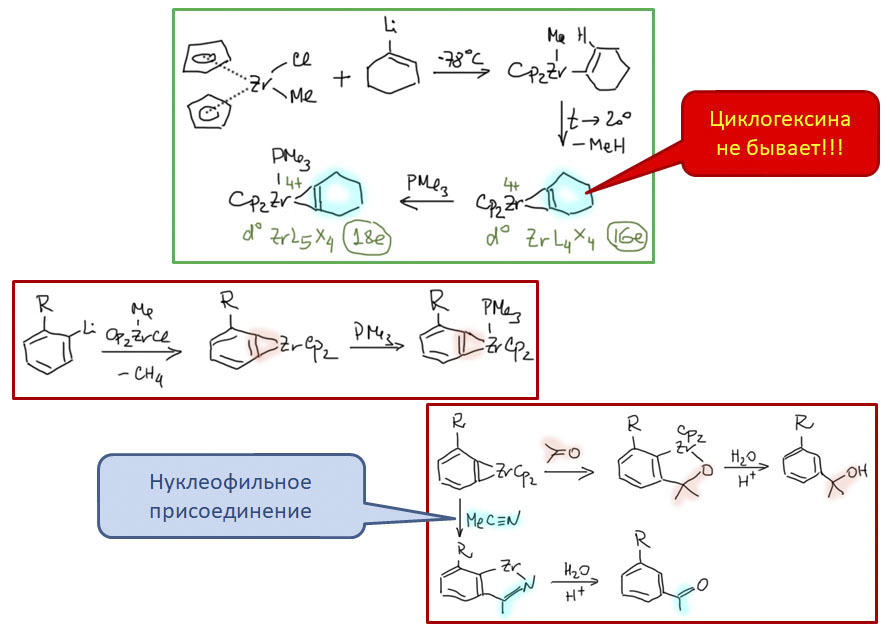
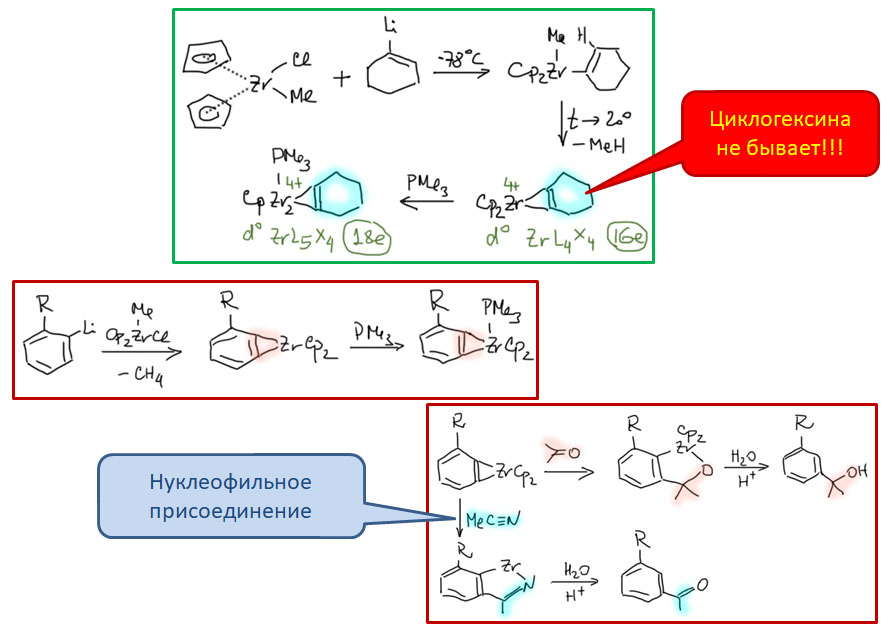
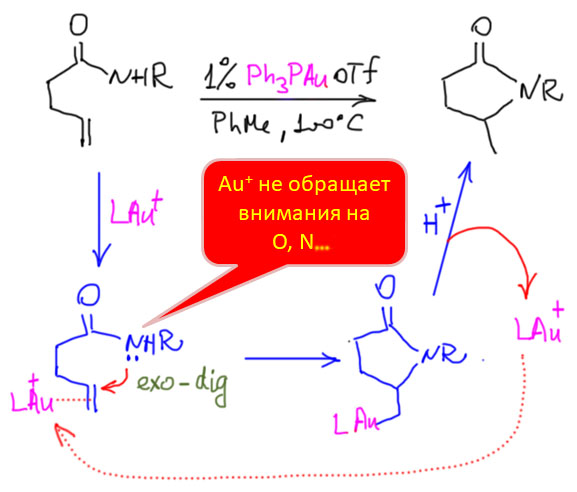
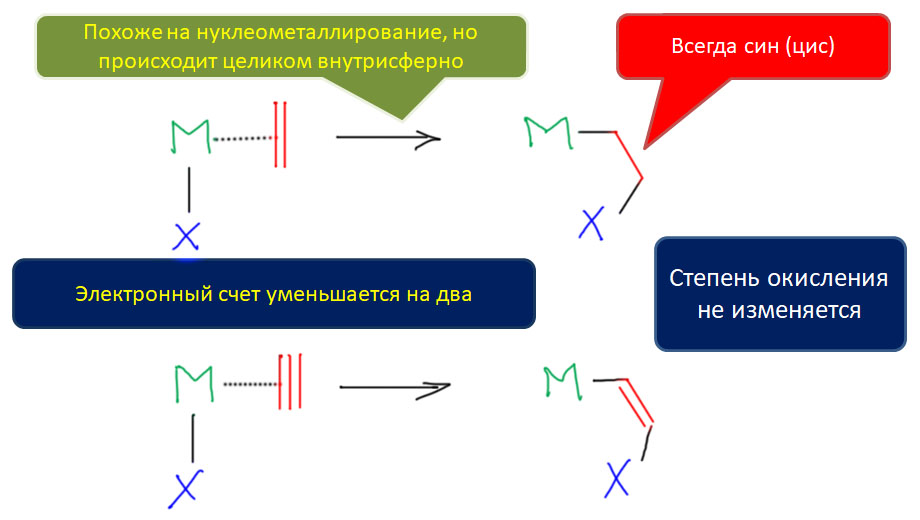
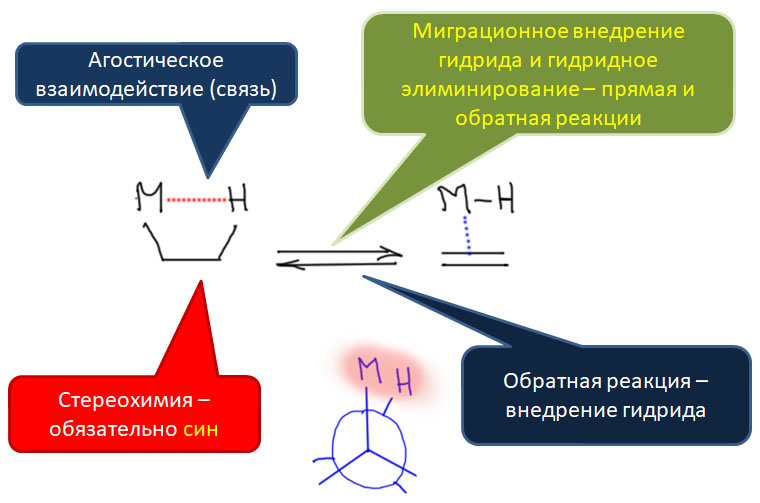
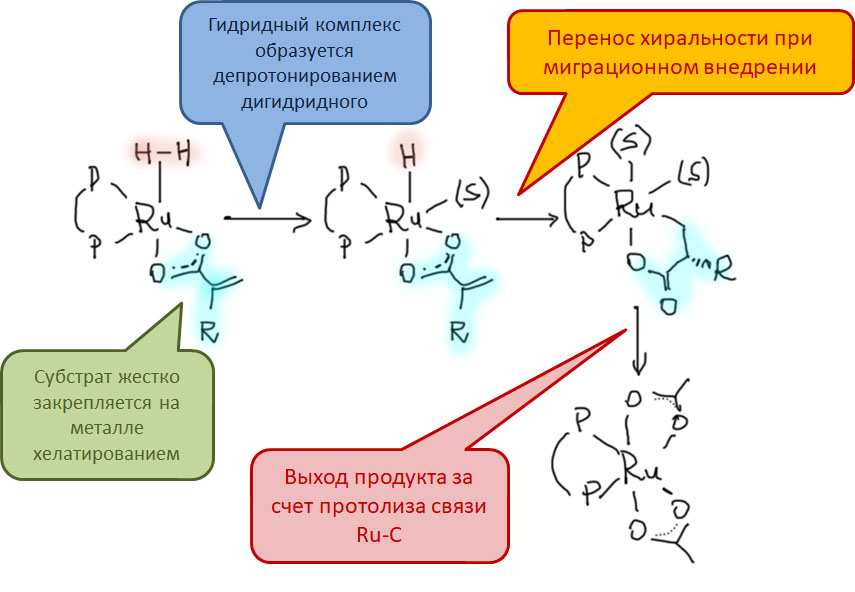
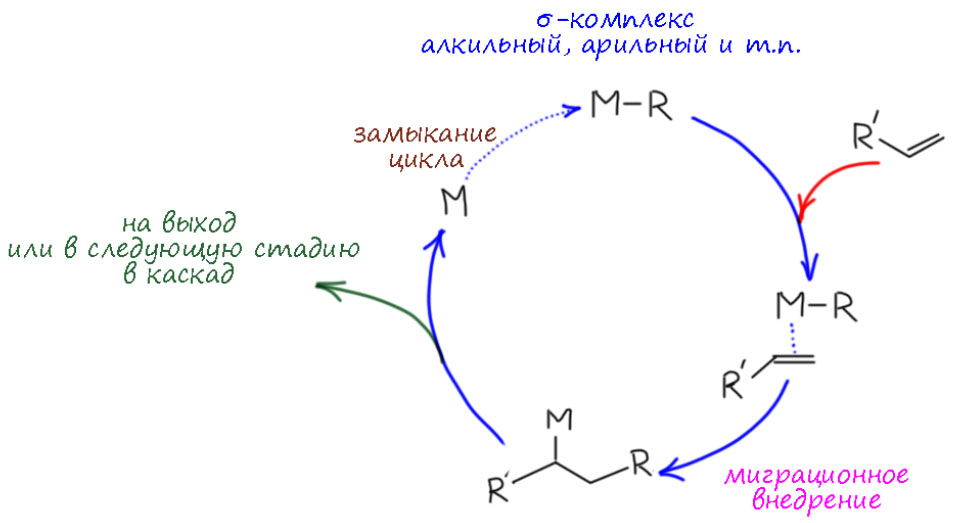
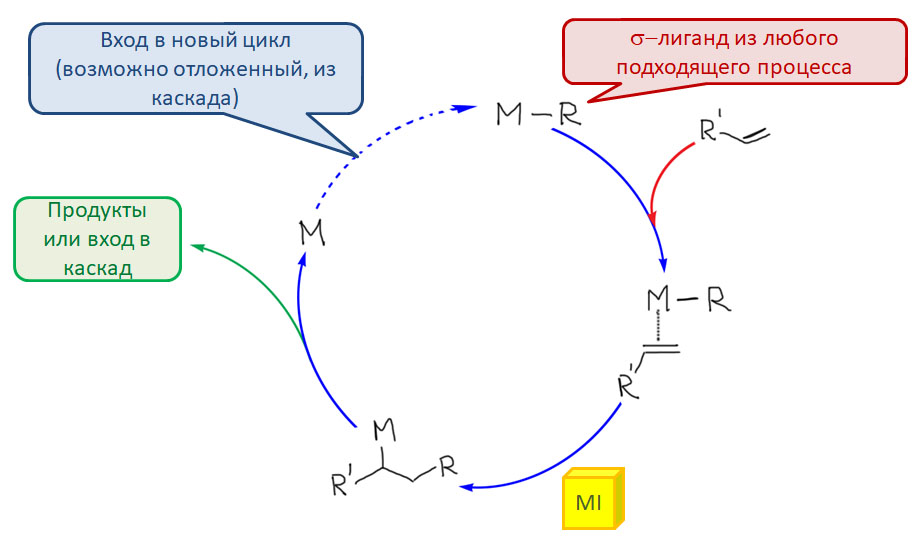
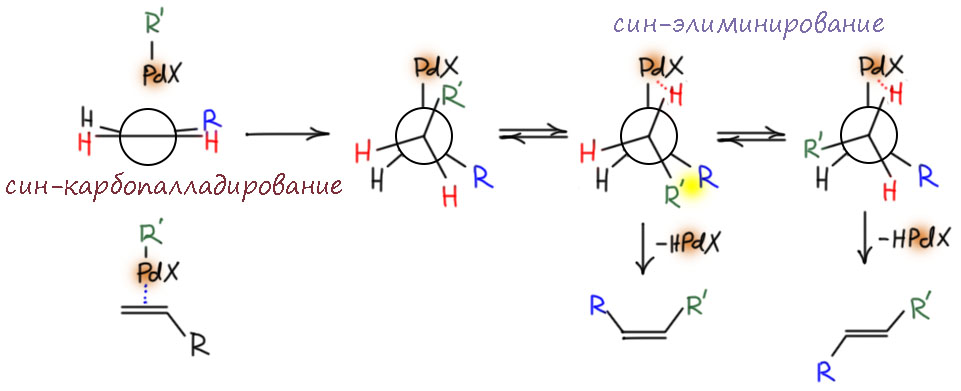
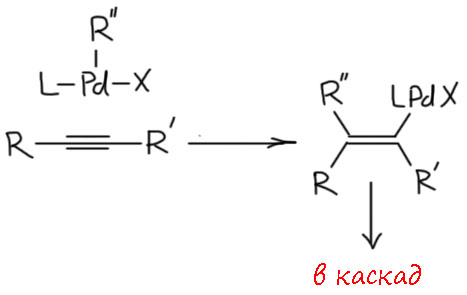
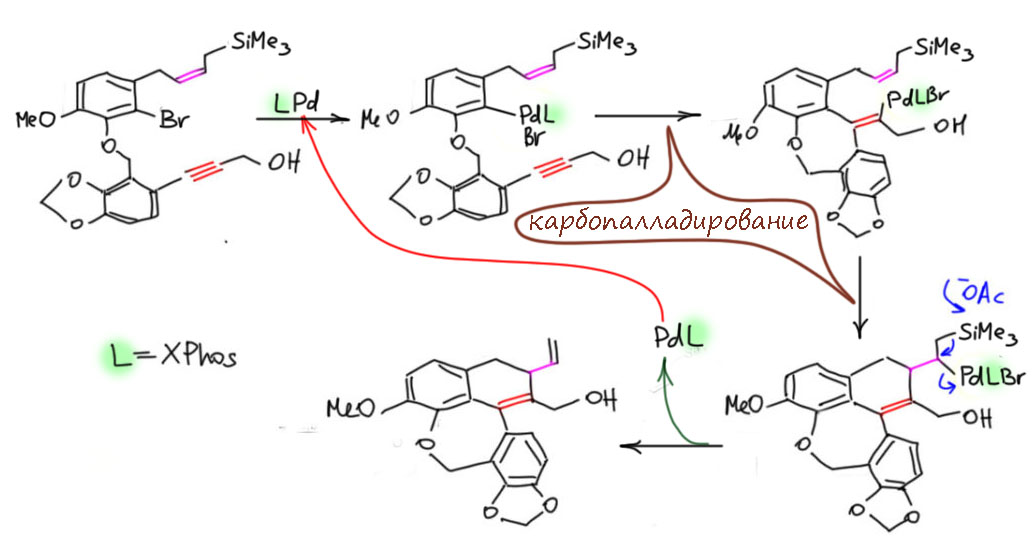
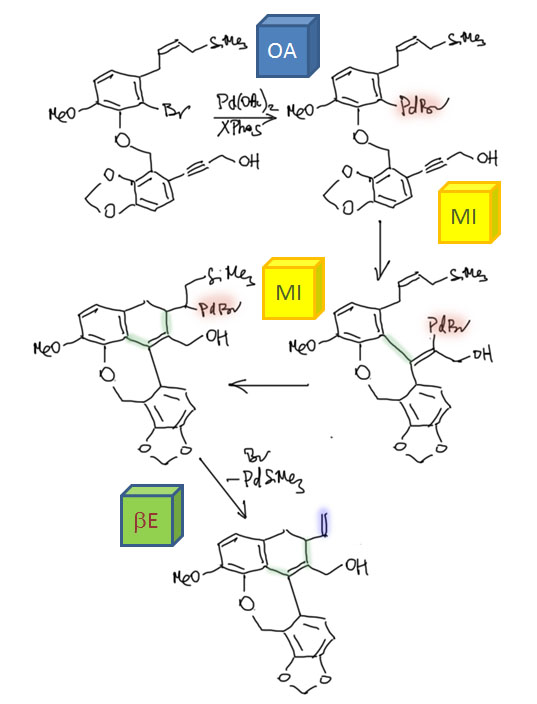
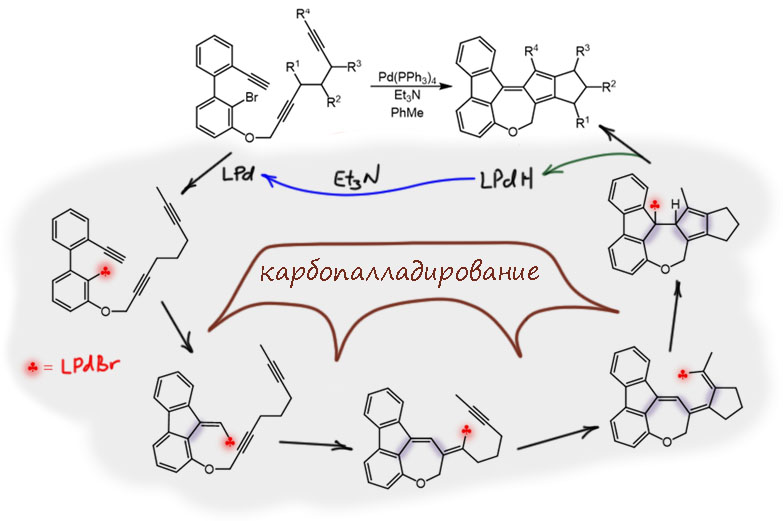
В этих случаях основной реакцией координированного олефина или ацетилена становится миграционное внедрение, происходящее по согласованному механизму в координационной сфере металла. Реакций, включающих стадии этого типа, огромное количество. Это и многочисленные реакции присоединения к кратным связям, в которых после миграционного внедрения металл замещается на какой-то другой фрагмент. Это и так называемые каскадные процессы, в которых стадия миграционного внедрения несколько раз повторяется, создавая сразу очень сложную структуру из достаточно простых исходных.
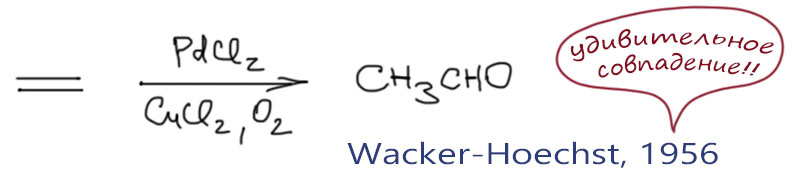
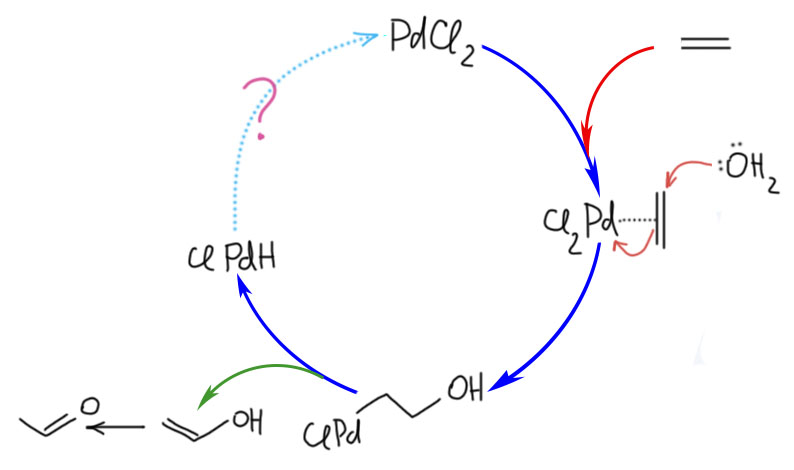
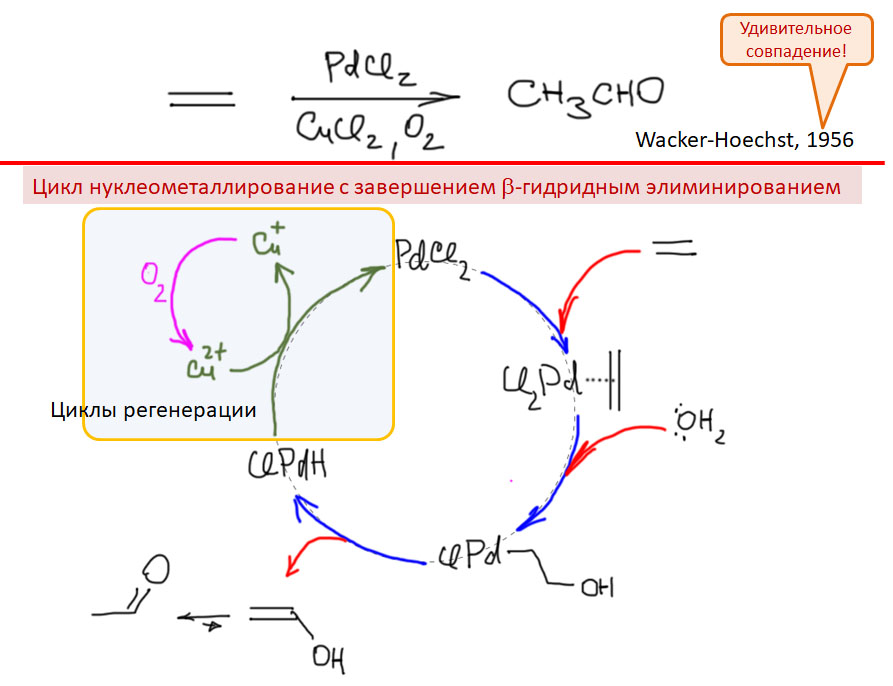
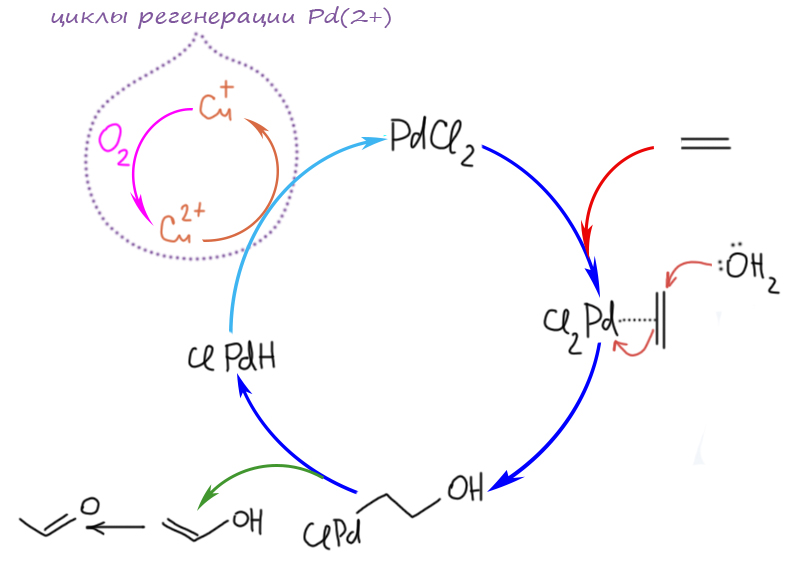
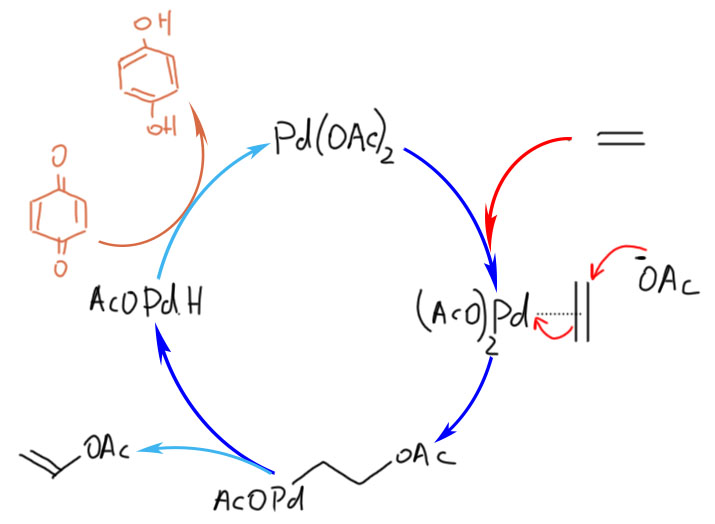
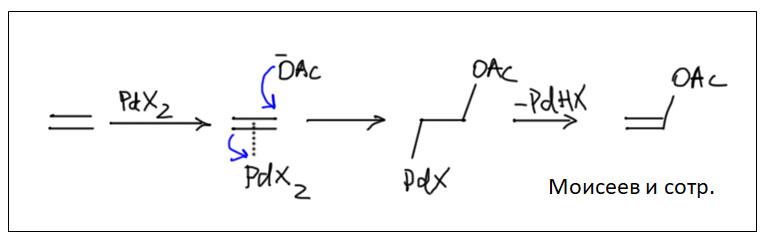
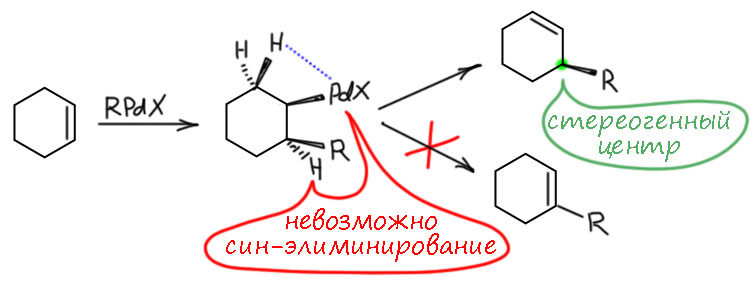
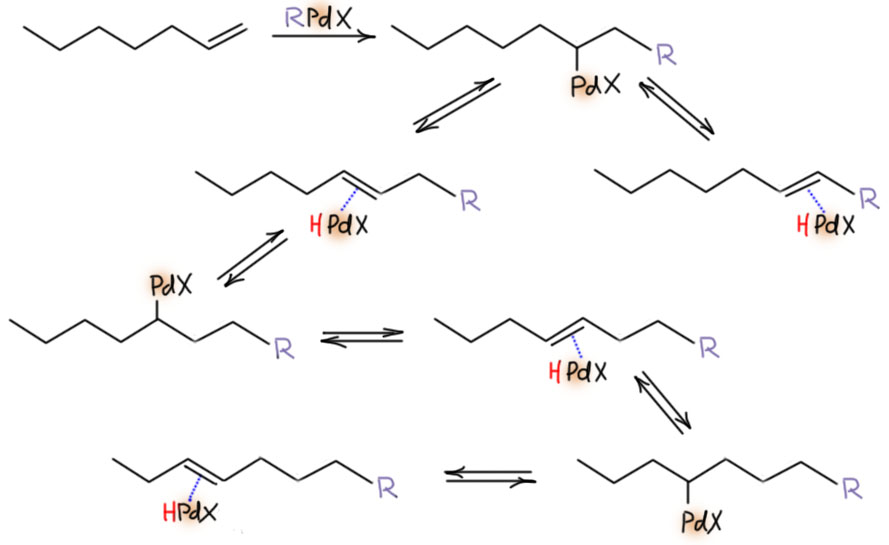
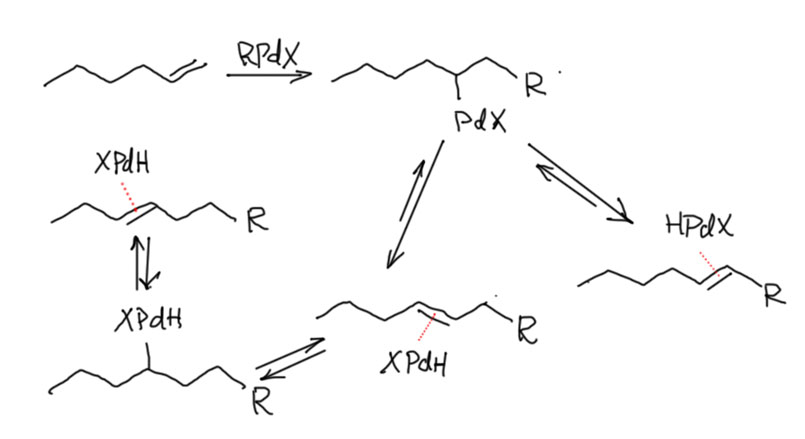
В близком родстве с миграционным внедрением находится реакция β-элиминирования. Мы очень хорошо знаем эту реакцию из обычной органической химии, где с ее помощью создают кратные связи. В химии переходных металлов все, на первый взгляд, очень похоже, но роль уходящей группы играет переходный металл, и именно он, а не внешнее основание эту реакцию инициирует. Стоит заметить, что реакция β-элиминирования не всегда играет положительную роль, и очень часто является причиной весьма неприятной побочной реакции, ведущей или к преждевременному выходу лигандов из координационной сферы, или к изомеризации олефиновых фрагментов и потере селективности.
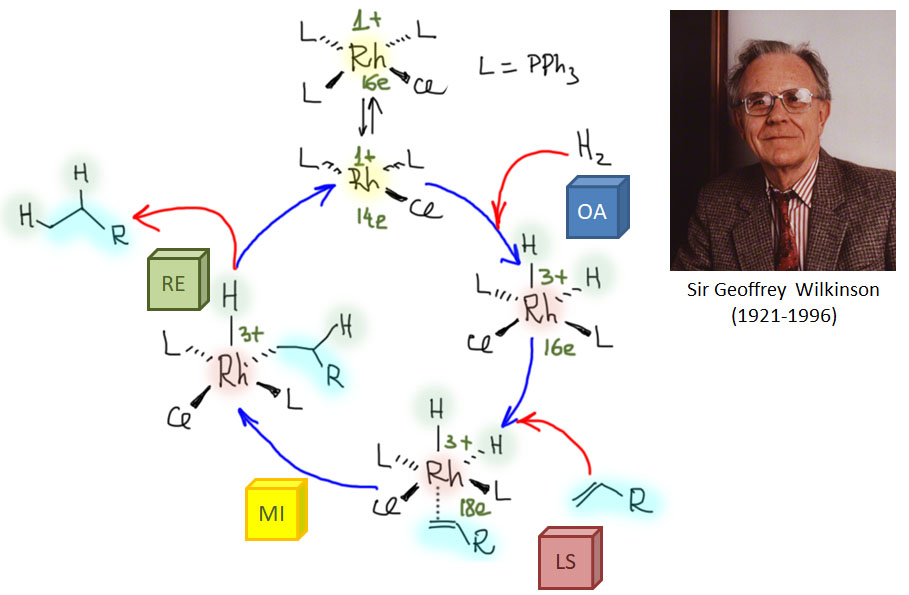
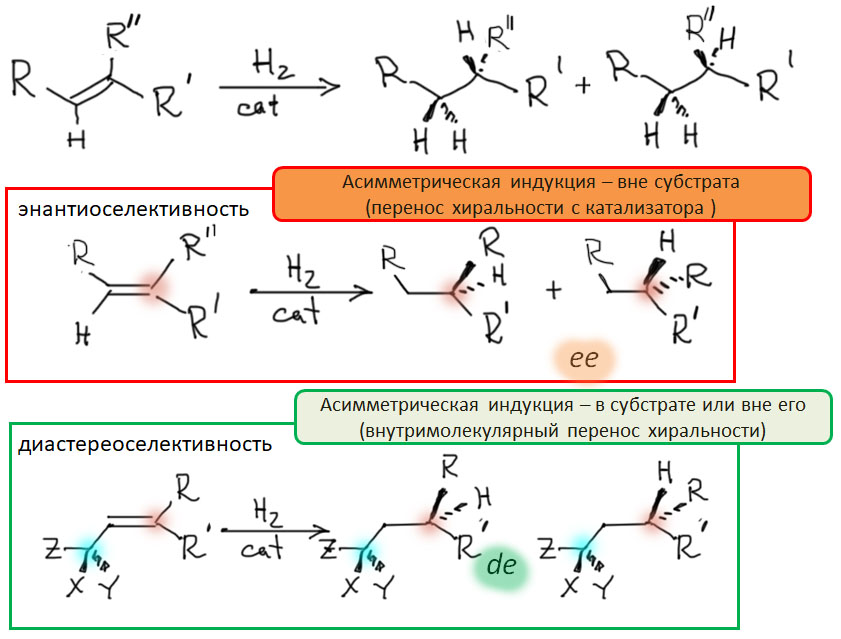
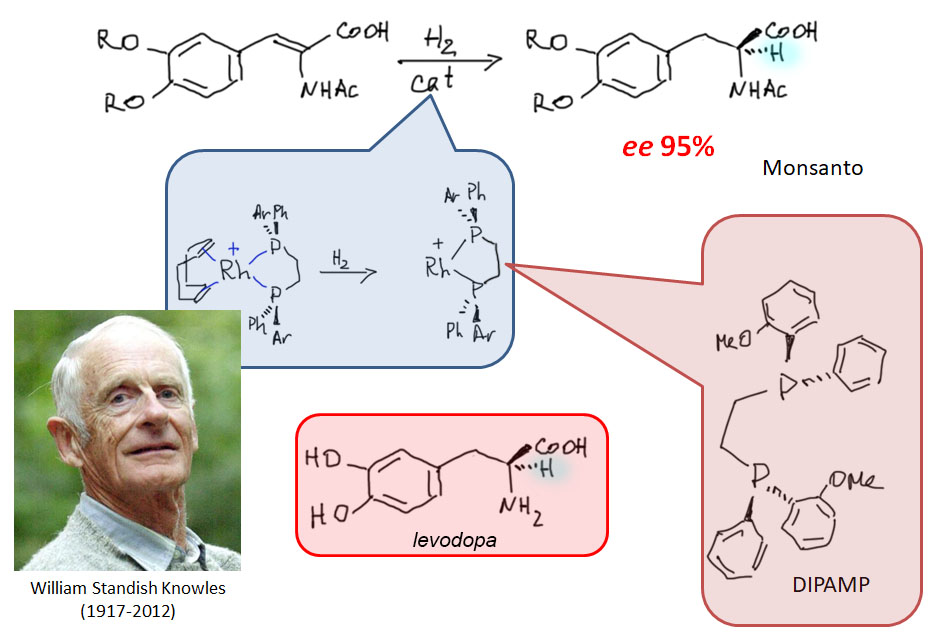
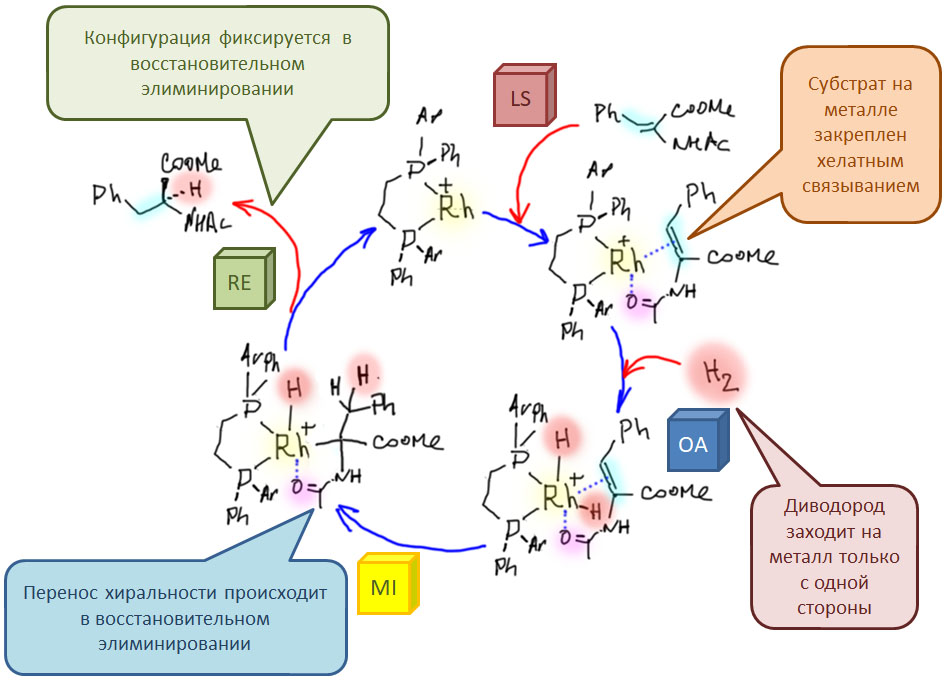
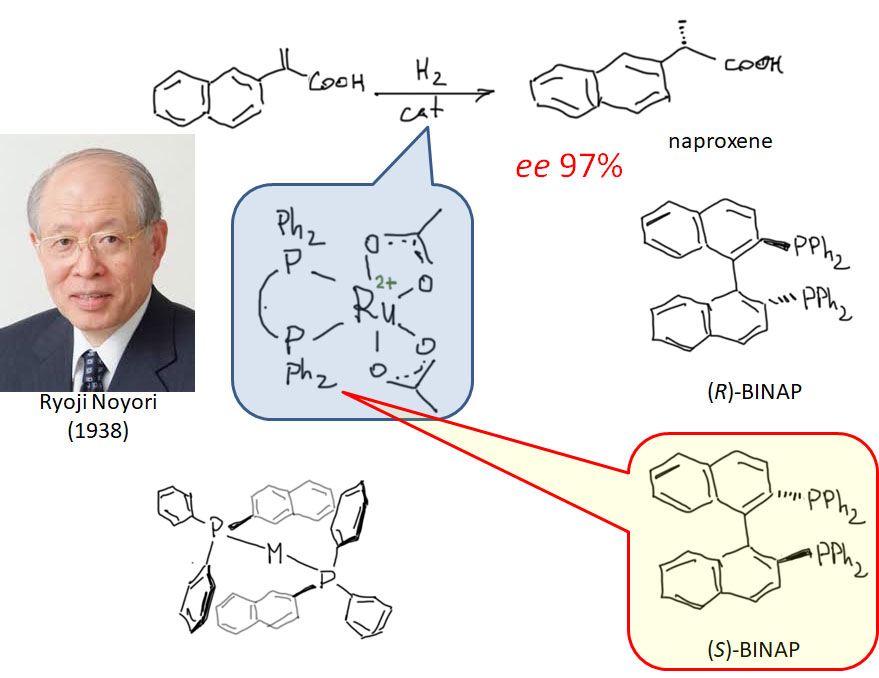
Последовательность окислительное присоединение – замещение лиганда – миграционное внедрение – восстановительное элиминирование встречается в десятках каталитических процессов. Типичным и одним из важнейших примеров таких процессов является гомогенное гидрирование. Сама по себе эта реакция очень важна для исследования каталитических процессов, но с точки зрения применения в синтезе не так интересна, потому что и так существует множество отличных катализаторов гетерогенного гидрирования, а при прочих равных условиях гетерогенный катализ удобнее. Но гомогенное гидрирование стало по настоящему важнейшей реакцией, когда был разработан его асимметрический вариант – получение оптически активных продуктов гидрирования из оптически неактивных олефинов с помощью хиральных катализаторов, в основном за счёт хиральных лигандов (возможна и хиральность на стереогенном атоме металла, и примеры таких комплексов и их применения есть, но это до сих пор довольно большая редкость).
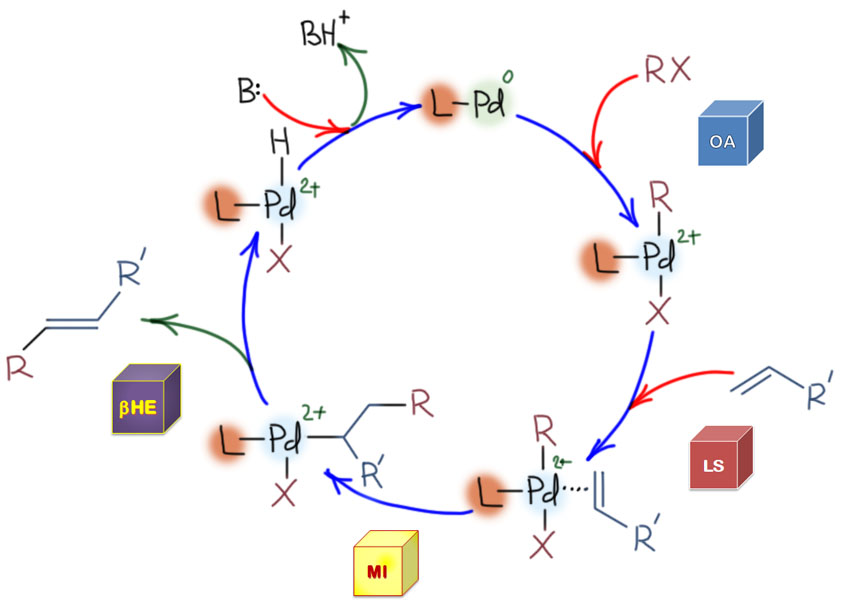
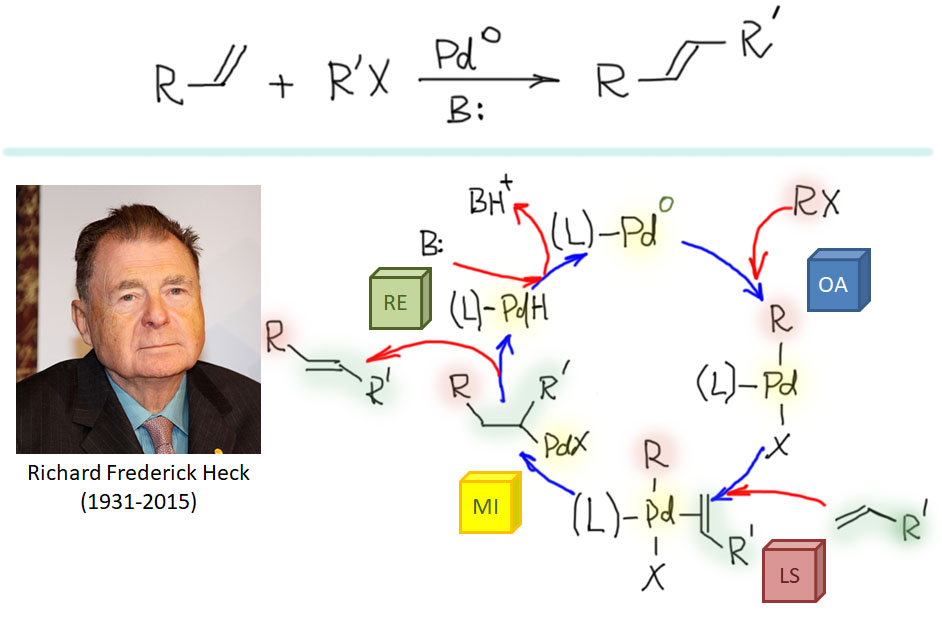
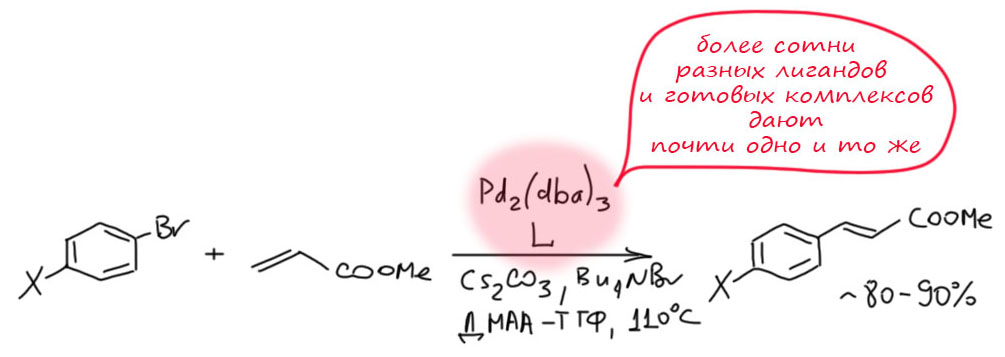
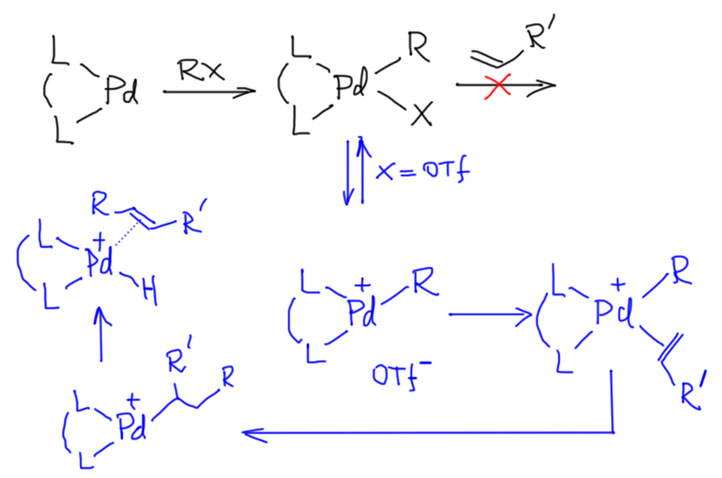
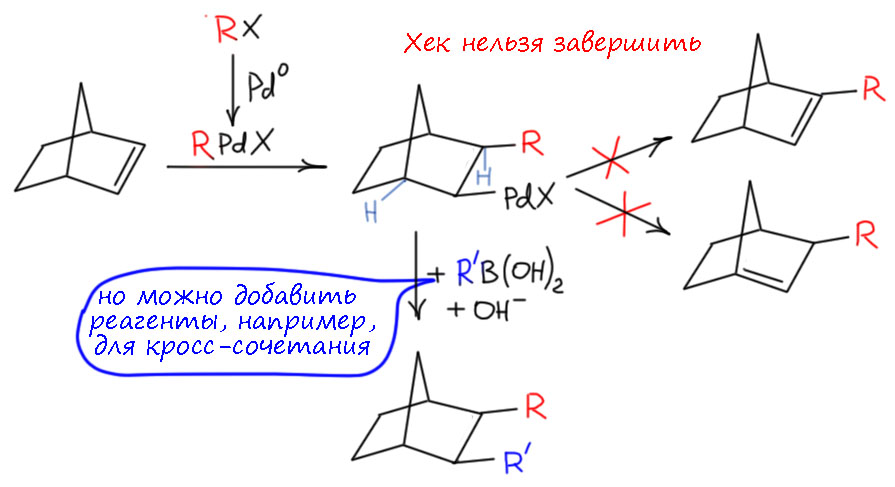
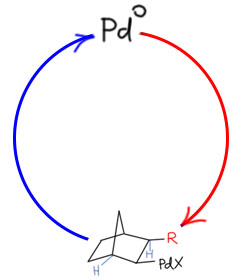
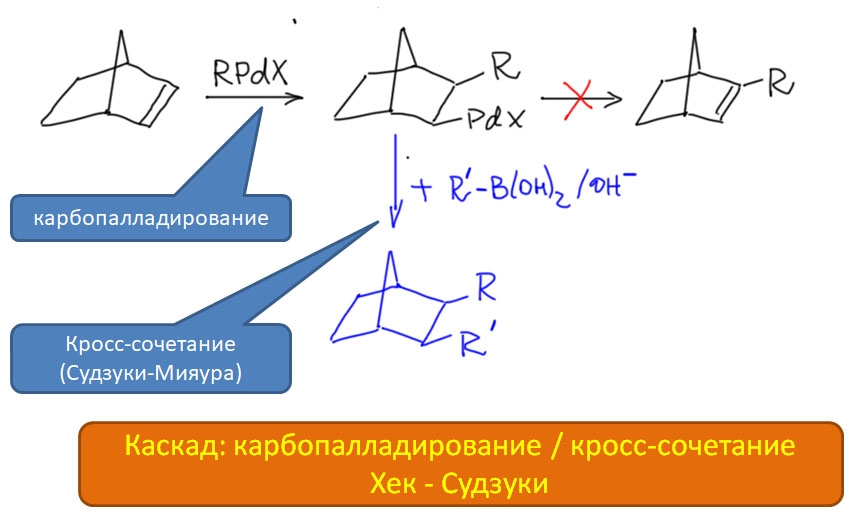
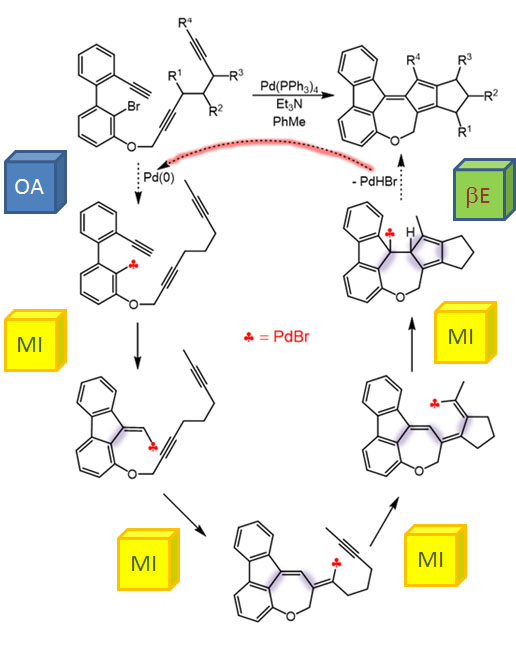
Но другой важнейший процесс описывается немного другим циклом, с другим завершением. Цикл окислительное присоединение – замещение лиганда – миграционное внедрение – β-гидридное элиминирование соответствует реакции Мидзороки-Хека. Но на этом история не кончается. В некоторых случаях реакция Мидзороки-Хека не может завершиться гидридным элиминированием по стереохимическим причинам, и тогда комплекс палладия с σ-органическим лигандом может принять участие в новых превращениях (еще одно карбапалладирование, всевозможные реакции кросс-сочетания, карбонилирование и т.п.), до тех пор пока каталитически активный комплекс палладия не будет регенерован для входа в новый цикл. Такие последовательности стадий происходят в рамках одного каталитического цикла и называются каскадами. Иногда еще используют термин domino reaction, имея в виду старинную забаву, когда костяшки домино ставят плашмя в длинный строй, и опрокидывая первую, вызывают лавинообразное заваливание всего построения. Когда костяшек много, это впечатляющее и незабываемое зрелище. Но я не люблю этот термин, считаю его избыточным (есть уже более точный и вполне определенный термин каскад), а что еще хуже, очень нечетким, потому что домино-реакциями иногда называют и тандемные процессы, а это уже терминологическая неразбериха и бардак.
Этот слайдер обновлён 17.04.2022. Новые или обновлённые слайды можно легко узнать по анимированным заголовкам и эффекту инверсии при наведении курсора на заголовок.