Периодическая система всегда под руками
В органической химии элементов немного, и можно не сомневаться, что любой человек, осмелившийся назвать себя химиком, помнит, где находится углерод, кислород, азот и галогены, и уж тем более водород. В химии переходных металлов элементов намного больше, и упомнить их все не всем по силам, и человек, даже отдавший химии всю жизнь, имеет полное право замешкаться, вспоминая, где, например, находится какой-нибудь иридий, и элемент ли это вообще, а может быть цветок какой аленький или синенький.
Но здесь это совершенно необходимо – мы все время будем считать электроны, оценивать положение элементов в группах и рядах, и не попадаться на глупые вопросы, например, про катализ кросс-сочетания фосфиновыми комплексами свинца. Фосфиновые комплексы у свинца вполне могут быть, но металл это непереходный, а следовательно нам в этом курсе малоинтересный. Вторая буква в символе просто предательская – перевернем ее и все встанет на свои места.
Поэтому сразу обзаведемся Периодической таблицей элементов. Для наших целей больше подходит не привычная с детства (раннего или позднего, кому как повезло) уютная и компактная короткопериодная таблица, восходящая еще к Д.И.Менделееву, а так называемая длиннопериодная. Историческая короткопериодная таблица была основана на ранжировании элементов по единственно доступному в глубокой древности параметру, атомным весам. Ни о каких электронах, а тем более атомных орбиталях, валентных оболочках и пр. тогда не было известно совершенно ничего. Короткопериодная форма поэтому мешает в группах элементы различных типов, разделяя их только по неочевидным на близорукий взгляд главным и побочным подгруппам. Но самая неудачная особенность исторической формы – запихивание 15 элементов в одну восьмую группу, что делает непростым понимание того, чем все эти восхитительные элементы различаются, и почему только им, благородным газам и металлам, и тройке более банальных металлов досталась такая свалка. Воздадим поэтому должное восхищение величию исторической Таблицы, и перейдем к более современной форме, которая построена по заполнению валентных уровней электронами, и четко разделяет разные блоки элементов.
Вот она, в некрасивом, но максимально авторитетном виде, рекомендованным Международным союзом по чистой и прикладной химии (IUPAC), в Номенклатуре неорганических и координационных соединений 2005 года. Многим она как-то интуитивно не нравится, она слишком длинная и плохо вписывается на задние страницы тетрадей и учебников, не умещается целиком в поле зрения, и вообще какая-то странно ступенчатая, на нормальную таблицу никак не похожа. Читать ее приходится, мотая головой слева направо и обратно, почти как болельщику на теннисном матче. Но структура у нее совершенно гениальная – элементы расположены строго по мере заполнения валентных оболочек, поэтому все элементы естественным путем образуют блоки s-, p-, d- и f-элементов (последние приходится вынести наружу, но место их в таблице хорошо понятно. Вместо восьми групп имеем 18, а это очень важное число в счете электронов, соответствующее полностью заполненной валентной spd-оболочке. Да, при этом оказались обижены первые три периода, которым эти 18 электронов могут только присниться, и которые обречены блюсти более скромный 2-х и 8-электронный счет (правило октета Льюиса), но это мелочи.
Кто-то может спросить, а какая разница, какой Таблицей пользоваться, все равно все понимают, как они устроены, и что там где. Безусловно это так, но здесь имеются в виду конкретные и простые вещи, в первую очередь система нумерации групп и рядов. Если мы будем, например, упоминать металлы 8-й группы, то это однозначно и только железо-рутений-осмий, а не вообще все 9 или даже 15 элементов, как в исторической таблице. И мы не будем падать в обморок от ссылок на элементы 10-й или 12-й групп. И не будем путать второй ряд переходных металлов с вторым периодом, и не будем возмущенно вопрошать, откуда там взялись переходные металлы, когда каждый знает, что во втором периоде из металлов только литий и бериллий.

D-Элементы
В длиннопериодной Таблице элементы расположены строго по мере заполнения валентных уровней, участвующих в образовании химических связей и вообще в любой химической деятельности. Напомню, что заполнение уровней атомов элементов происходит в соответствии с их относительной энергией снизу вверх (это называется принципом Aufbau, в разных формулировках также называется принципом Маделунга-Клечковского), причем эмпирически (спектроскопически) установлен порядок заполнения, удобно представляемый простой диаграммой: выписываем все уровни в порядке появления, и дальше снимаем слоями по диагонали. Получаем сразу и принцип заполнения оболочек, и то, как происходит комплектование периодов в Таблице. Только в первых трех периодах уровни заполняются просто и скучно – по номеру оболочки (точнее, значению главного квантового числа n). В четвертом и пятом d-уровни из предыдущей оболочки выплывают и встают между очередными s и p-уровнями. Это очень важно, так как в значительной степени определяет место интересующих нас элементов, переходных металлов, в Таблице – они нагло влезают между s- и р-элементами, то есть между самыми металлическими металлами (щелочными и щелочноземельными) и неметаллами вместе с примкнувшими к ним металлоидами и горсткой непереходных металлов. Валентные оболочки в этих двух периодах содержат s, p, d уровни, то есть в сумме могут принять 18 электронов. Как увидим скоро, это священное число химии переходных металлов. В шестом периоде происходит следующий сюрприз – влезает “забытый” f-уровень с на две единицы меньшим номером, причем до d-уровня, и его неспешное заполнение дает семейство f-элементов, лантанидов. А уж дальше идут нормальные d-элементы, но сильно отличающиеся от родственников с верхних этажей как раз наличием этого уже заполненного f-уровня. Можно было бы ожидать, что в этом ряду произойдет и расширение числа электронов на валентной оболочке на 14 f-электронов, но это не так – заполненный f-уровень становится внутренним, и напрямую в образовании связей не участвует, валентная оболочка по-прежнему остается sdp-типа и вмещает 18 электронов, а на особые свойства этих элементов довесок в виде полного f-уровня влияет косвенно, в основном через эффект сильно потяжелевшего и несущего очень большой дополнительный положительный заряд ядра. Про следующий период говорить ничего не будем, там все радиоактивное и малостабильное, кроме самого начала очередной порции f-элементов, но мы договорились, что f-элементами заниматься не будем вообще. Пока не сбылось древнее пророчество о наличии “островка стабильности” среди трансурановых элементов, пополнения семейства переходных металлов чем-то осязаемым ждать не приходится. В 7 периоде ничего не появилось, хотя он полностью заполнен и даже названия все даны. Подождем восьмого.

Пометим в Периодической таблице тип заполнямых уровней. Слева две группы (1 и 2-я) s-элементов, щелочных и щелочноземельных металлов. Справа 6 групп (от 13-й по 18-ю) p-элементов, там все, что нужно для нормальной органической химии. В середину попадают d-элементы, мы выделили их зелененьким, не знаю, почему-то мне кажется, что переходным металлам идет этот цвет. В этом месте насторожимся и спросим себя (если больше некого), а d-элементы и переходные металлы, это одно и то же? Почти, но не совсем. Чтобы понять, в чем фокус, придется повнимательнее посмотреть на заполнение уровней. Про f-элементы тоже уже все ясно, оставим их в покое. Там есть одна проблема: какой из элементов, занимающих одну клетку под иттрием, является переходным металлом и аналогом иттрия и скандия – первый или последний, лантан или лютеций. У обоих одинаковая валентная оболочка 6s25d1, но у лантана вообще нет f-электронов (но уровень-то пустой есть!), а у лютеция f-оболочка полностью заполнена точно так же как у всех переходных металлов третьего ряда. Простого ответа на этот очевидный вопрос, увы, нет.

Электроны на d-уровне
Посмотрим теперь на d-элементы повнимательнее. Есть три полных ряда таких элементов. В каждом последовательно заполняется соответствующий d-уровень. Всего d-орбиталей пять, а d-электронов, соответственно, десять. Поэтому и в каждом ряду есть десять элементов, располагающихся в группах от 3 до 12. Номера групп с 3 по 7 соответствуют исторической Таблице Менделеева, только там используется понятие “побочная подгруппа”, а в длиннопериодной Таблице все группы равноправны (хотя термин main group elements, элементы главных (под)групп, очень широко распространен для обозначения s- и p-элементов и не собирается сдавать позиции). При заполнении оболочек у атома каждого элемента, к сожалению, наблюдаются достаточно серьезные отклонения от простого порядка, когда каждый следующий электрон просто занимал бы следующее свободное место. Электроны вообще очень капризные ребята, их квантовые привычки непросто понять и запомнить. В первом ряду все еще достаточно просто, достаточно усвоить, что при возможности полностью заполнить (в каждой ячейке по два спаренных) или полузаполнить (в каждой ячейке по одному неспаренному) d-уровень, все остальное уходит на второй план, и выбивающуюся из ряда конфигурацию атомов хрома или меди, заимствующих электрон с уже заполненного s-уровня, запомнить несложно. Но во втором или третьем ряду даже эти простые идеи как-то перестают работать однозначно.
К счастью, в реальной химии редко имеют дело с одиночными атомами, а когда образуется коодинационное соединение, комплекс, картина просто радикально упрощается. Считается, что так как в образовании связей с лигандами в первую очередь участвуют именно d-орбитали, то в комплексах они стабилизируются и опускаются ниже s-орбиталей.
А если это объяснение кажется несколько натянутым и неубедительным, то можно просто подумать о том, что в комплексах металлов все равно из валентных орбиталей металла и орбиталей лигандов образуются новые орбитали комплекса, металл все равно отдает на это все, что у него есть, и электроны придется переразмещать заново, снизу вверх, уже на орбиталях комплекса, далеко не все из которых сохранят чистый d-характер как в исходном атоме металла. Поэтому то, что называется d-электронной конфигурацией атома металла в комплексе, на самом деле совершенная формальность, а раз так, то нет смысла это усложнять и лучше воспользоваться самым простым вариантом из возможных – берем все, что есть, и для удобства считаем размещенным на d-орбиталях металла.
Иными словами, для целей координационной химии электроны на атомах металлов в степени окисления 0 (что это означает, скоро обсудим, а пока примем просто за точку отсчета) размещаются на d-орбиталях, пока уровень не будет заполнен полностью. Это невероятно удобно, потому что число d-электронов становится равным номеру группы в длиннопериодной Таблице. Сколько валентных электронов, скажем, у ниобия? – ниобий в 5 группе, значит пять. А у иридия? – в 9-й группе, значит девять.
Так и будет до 10 группы (никель-палладий-платина), когда d-уровень полностью заполнится, и настанет черед s-уровня, того самого, который в изолированном атоме был ниже d-уровня. Теперь он выше и берет первый следующий электрон в 11 группе (медь-серебро-золото), образуя конфигурацию с полностью заполненным d-уровнем, который поэтому сразу становится внутренним, и полузаполненным s-уровнем. О, так значит металлы этой группы не переходные металлы, а s-элементы, и права была историческая таблица Менделеева, когда помещала их в одну группу с щелочными металлами? Права, но не совсем, и в следующем слайде мы увидим, что претензии металлов группы меди на то, чтобы на полных основаниях примыкать к семье переходных металлов, очень основательны. А вот в 12 группе положение, на первый взгляд, похожее, но на самом деле радикально другое – там второй электрон попадает на s-уровень, а d-уровень окончательно становится внутренним.
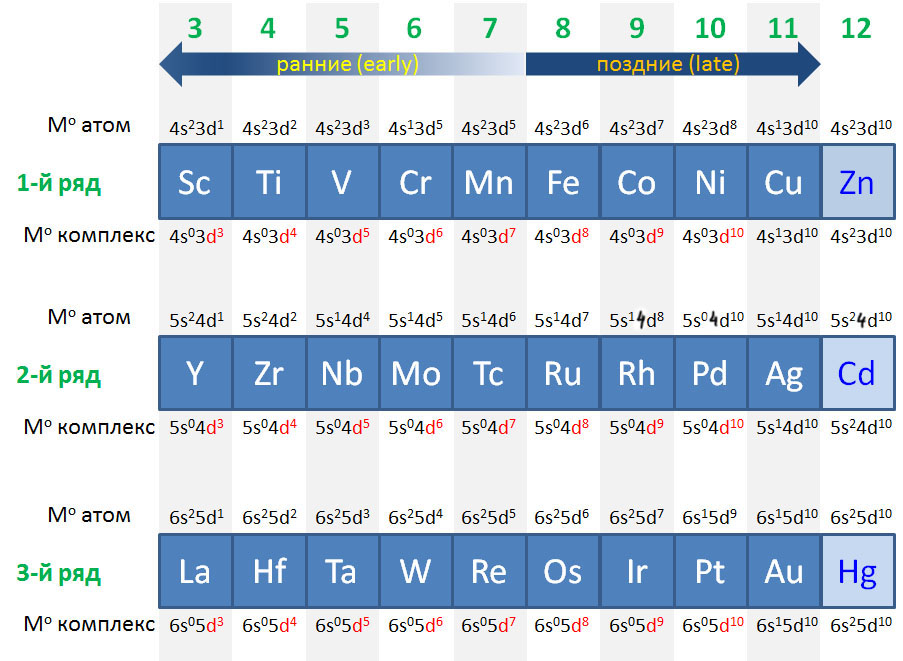
Валентные состояния d-элементов. Переходные металлы.
Легко определить и число электронов на атомах металлов в разных степенях окисления. Для металлов характерны положительные степени окисления (есть и отрицательные, но об этом после). Так как положительная степень окисления – это просто недостаток электронов до числа, положенного каждому элементу, берем нульвалентный элемент и вычитаем. Вот что получается для первого ряда (для остальных будет то же самое). Очевидно, что отнять у атома больше, чем у него есть, невозможно. Поэтому максимальная положительная степень окисления не может быть больше номера группы, но не больше восьми. В этом одна из причин деления переходных металлов на ранние и поздние. Ранние – это те, которых можно достаточно легко ободрать до нитки (до d0), а поздние – те, которые этому успешно сопротивляются. Железо – поздний переходный металл, хотя у него есть степень окисления +8, но достичь ее очень трудно и она очень неустойчива. Во втором и третьем ряду металлы легче расстаются с электронами, и степени окисления +8 для рутения и особенно осмия намного проще достигаются (недавняя история с радиоактивным загрязнением изотопом рутения этим и объясняется), но все равно эти элементы классифицируются как поздние переходные металлы. Вообще, группы 7 и 8 иногда обзывают как ни то, ни се (middle transition metals), но это скверная привычка. Чуть позже уточним эту странную классификацию (ранние-поздние), так как она играет значительную роль в химии переходных металлов.
Так что же такое “переходный металл” и одно ли это и то же, что d-элемент. Не совсем. D-элементы – это более формальное понятие, так как число каждого из типов элементов в периоде соответствует предельной емкости оболочки: s-элеметов два, p-элементов шесть, d-элементов десять, ну и все – отсчитываем от скандия десять, приезжаем в цинк, вопрос закрыт. А вот термин “переходный металл” имеет более существенное наполнение, хотя оно и менялось с течением времени. Более-менее устоявшийся подход состоит в том, что элемент имеет право так называться, если у него есть валентные состояния, в которых d-оболочка неполна (имеет меньше 10 электронов), в этом случае d-электроны точно участвуют в образовании связей. Если d-оболочка либо всегда пустая, либо всегда полная, участие d-электронов в образовании связей не очевидно и долго являлось предметом споров. Это старая проблема, связанная с так называемыми гипервалентными состояниями p-элементов, которым прописан валентный октет, но которые, начиная с 3 периода, как это следует из общепринятых структурных формул, умеют образовывать больше ковалентных связей, чем этот октет позволяет. Когда структурная химия была еще очень молода, и еще не совсем освоила электронную теорию химической связи, такие состояния (например, сера и другие халькогены в шестивалентном состоянии, или фосфор и его аналоги в пятивалентном состоянии) часто приписывались участию вакантных d-орбиталей, которые таким образом неявно становились валентными. В современной химии так делать не принято, считается анахронизмом, признаком приверженности преданиям далекой старины, а правило октета Льюиса считается в химии непереходных элементов незыблемым, а поэтому такие элементы не имеют право называться d-элементами.
Следовательно, элементы 12 группы (цинк-кадмий-ртуть) не являются переходными металлами, d-оболочка у них всегда заполнена и спрятана очень глубоко – в комплексах этих металлов граничные орбитали всегда сидят только на лигандах, почти никогда не бывает смещения электронной плотности металл-лиганд и других атрибутов электронной структуры комплексов настоящих переходных металлов. Эти металлы очень похожи на обычные непереходные p-элементы, следующие прямо за ними: цинк-галлий, кадмий-индий и особенно ртуть-таллий-свинец.

Или ничего, или всё: ранние и поздние переходные металлы
Деление переходных металлов на ранние и поздние очень популярно и часто используется, но точного определения не имеет. Это деление связано с одной очень понятной тенденцией в заполнении валентных оболочек и устойчивости валентных состояний разных элементов. Аналогия довольно прозрачная: где в таблице находятся самые металлические (наиболее электроположительные или наименее электроотрицательные) металлы (щелочные и щелочноземельные)? Слева, в начале периодов. А где находятся самые неметаллические (самые электроотрицательные) неметаллы (галогены и кислород)? Справа, в конце периодов. У первых очень мало электронов, проще их отдать, образуя катионы с зарядом, соответствующим номеру группы. У вторых, наоборот, почти полный комплект, и хочется получить недостающее.
Очень похожая картина наблюдается и в рядах переходных металлов. Те, что ближе к началу, предпочитают отдавать электроны. Их любимые степени окисления соответствуют конфигурациям d0 и d2, то есть высокие степени окисления от +3 и выше, соответствующие номеру группы, что роднит их с непереходными металлами. В реакциях они часто проявляют льюисову кислотность и электрофильность, в состоянии d0 имеют много общего с непереходными металлами, в частности высокую степень ионности связей с лигандами. Что все это значит, мы подробно разберем дальше, пока просто отметим эти особенности. К ранним переходным металлам почти всегда относят группы с 3-ей по 6-ю, и довольно часто присоединяют и седьмую.
С другой стороны, металлы в конце уже имеют много d-электронов, настолько много, что отдать их все всё равно невозможно. Тогда проще или сохранить имеющееся, или даже приобрести недостающие до полного комплекта. Эти металлы не любят высокие степени окисления, которые редко превышают +4, а наиболее распространенными являются +1 и +2. Самые популярные конфигурации d8 и d10. Им свойственны так называемые низковалентные состояния (степени окисления 0 и +1), и даже небольшие отрицательные степени окисления -1 и -2, а в реакциях они часто проявляют нуклеофильность.
Металлы 11-й группы (медь-серебро-золото) – особенные. Так как d-оболочка у них заполнена, а новый электрон поступил на s-уровень, то им естественно его легко отдать. В этом они вроде бы похожи на ранние переходные металлы, а точнее даже на непереходные щелочные металлы, не зря же в исторической Таблице они делили одну первую группу. Но, потеряв этот электрон в валентных состояниях Cu(+1), Ag(+1), Au(+1), они приобретают конфигурацию d10, типичную для поздних переходных металлов, например, для валентных состояний Ni(0), Pd(0), Pt(0), Co(-1), играющих без преувеличения колоссальную роль в той науке, которую мы взялись изучать. Еще у элементов группы меди есть состояния M(+3) (особенно характерно для золота, но и для меди, и, в наименьшей степени, для серебра, эта степень окисления не чужда и играет заметную роль в реакциях), и это d8, также типичная конфигурация для поздних переходных металлов. Поэтому металлы 11 группы имеют право примыкать к поздним переходным металлам, и мы увидим дальше, что медь не заставляет за себя краснеть даже самых благородных представителей этого семейства – это один из самых универсальных металлов, успешно обслуживающий десятки самых разнообразных процессов. У остальных металлов группы химия тоже богатая и очень полезная, но более далекая от типичной для семейства. Наиболее сильное отличие металлов группы меди от металлов 8-10 групп состоит в отсутствии так называемых низковалентных состояний (M(0), M(-1), M(-2)), всегда получаемых восстановлением более устойчивых валентных состояний. Cu(+1) имеет множество признаков сходства с низковалентными состояниями металлов 8-10 групп, но и очень важное отличие, – это фактически и есть основное валентное состояние меди в координационных соединениях, особенно металлоорганических. Это очень существенное отличие, и мы к нему еще вернемся.

В заключение подчеркнем, что деление переходных металлов на ранние и поздние – просто удобное упрощение, позволяющее грубо классифицировать элементы и в самых общих чертах понимать, какой химии мы ожидаем от представителей групп. Сказать точно, где кончаются первые и начинаются вторые, и наоборот, точно невозможно и не имеет никакого смысла. Собственно как и в химии непереходных элементов, где совершенно нет четкого представления о том, где кончаются неметаллы и начинаются металлы, из-за чего в той химии даже появляется пограничная группа металлоидов, столь же нечеткая. Тем более не имеет смысла выделение в особую группу каких-то средних переходных металлов, хотя этот термин встретить можно, но крайне трудно понять, что же он может означать, и зачем его вводить. Один средневековый христианский мыслитель, брат Вильям Оккамский, советовал в любой мыслительной деятельности не умножать сущностей сверх необходимого, то есть не вводить избыточных и нечетких понятий там, где уже существуют более осмысленные и определенные понятия. Вот и мы не будем, и обойдемся ранними и поздними переходными металлами. К тому же не стоит забывать, что в действительности каждый – каждый! – металл уникален, ни один не повторяет свойства другого хотя бы на 10%, и каждый имеет свою уникальную роль, свои реакции, свое применение, ни один нельзя заменить на другой, а все вместе они создают фантастическое разнообразие молекул и взаимодействий.
