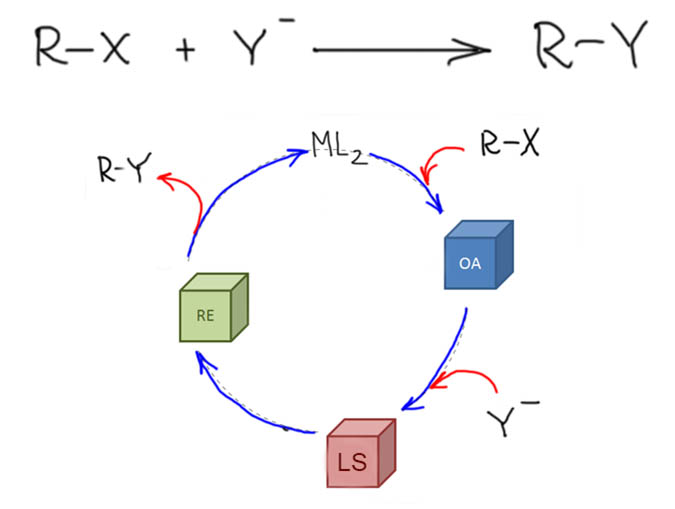
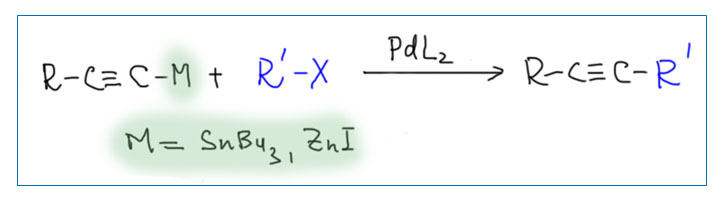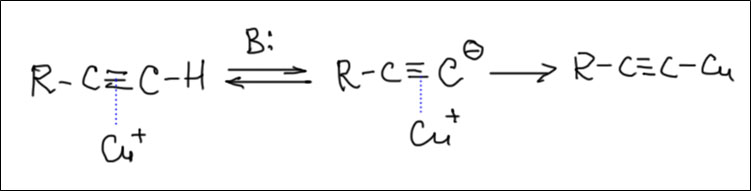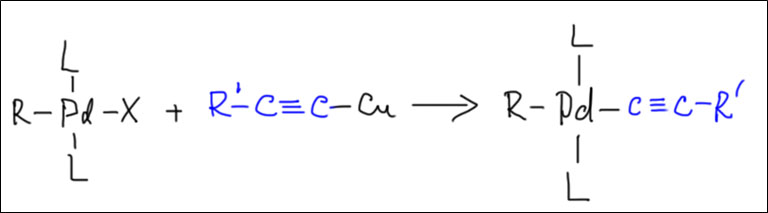Кросс-сочетание. Развитие.
Классическое кросс-сочетание основано на использовании нуклеофилов в виде металлоорганических соединений, загружающих нуклеофильный компонент кросс-сочетания реакцией переметаллирования. Это кажется формальным и немного случайным, но на самом деле, это принципиальный признак раннего этапа открытия и первоначального периода этой химии. Поэтому мы называем такие реакции классическим кросс-сочетанием. Это не общеупотребительный термин, и не результат консенсуса в среде исследователей этой химии,но те, кто долго и внимательно следил за развитием этой области, скорее всего, согласятся с такой периодизацией.
Классическое кросс-сочетание основано на реакции переметаллирования для загрузки нуклеофила на металл, и поэтому всегда использует металлоорганические соединения в качестве нуклеофилов, и, за единственным исключением магнийорганики в реакции КТК, это – малореакционноспособная металлоорганика с умеренной или вовсе почти полностью отсутствующей собственной нуклеофильностью и основностью. Мы будим нуклеофильность с помощью переметаллирования – без этого она скрыта. И мы вообще не трогаем основность – она и не проявляется.
Почему это чертовски важно? Потому что собственная реакционная способность (нуклеофильность и основность) не мешаются под ногами, вызывая множество возможных побочных реакций, которые имели бы все шансы стать основными и послать желанное кросс-сочетание куда подальше. Основность мешала бы, вызывая элиминирование, а также образование совсем не тех комплексов переходного металла, которые ожидаются в каталитическом цикле кросс-сочетания. Явная нуклеофильность тоже не подарок – она сильно ограничивала бы круг субстратов, которые можно использовать. Строго говоря, в реакции с магнийорганикой (реакции Кумады-Тамао-Коррью) мы почти всё это видим, и уже выяснили, что эта реакция очень ограничена, но в тех случаях, когда она применима, её спасает огромная скорость кросс-сочетания. А вот с литий-органикой этот номер уже не проходит – кросс-сочетание с литий-органикой не идёт в таких условиях, и требует специальных условий и решений.
Что требуется для того, чтобы выйти за рамки классического кросс-сочетания? Прежде чем начинать отвечать на этот вопрос, зададим другой вопрос – а зачем нужно выходить за эти рамки? Хотя бы потому, что это удобно и сильно расширило бы рамки метода. Но также и потому, что мы договорились, что в современной химии огромную роль играют экономические и экологические аспекты: то, что мы называем “принципом экономии атомов”, ну и всё, связанное с отходами реакций, их токсичностью. Как бы ни было прекрасно кросс-сочетание с олово-органикой, работа с этими веществами очень опасна и требует особой аккуратности. Цинк и бор менее опасны, но ведь эти элементы и всё что на них ещё висит – отходы, и небезобидные, и дорогостоящие.
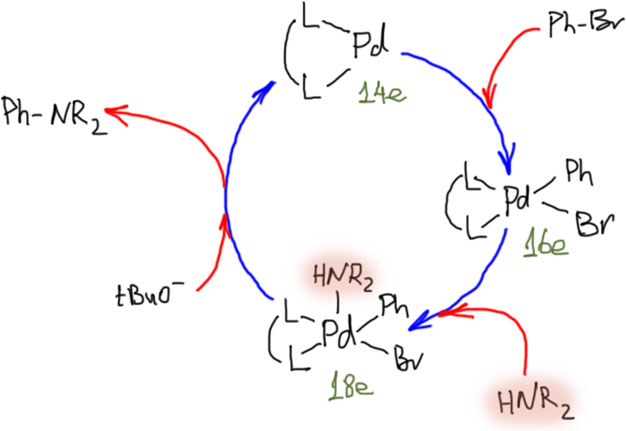
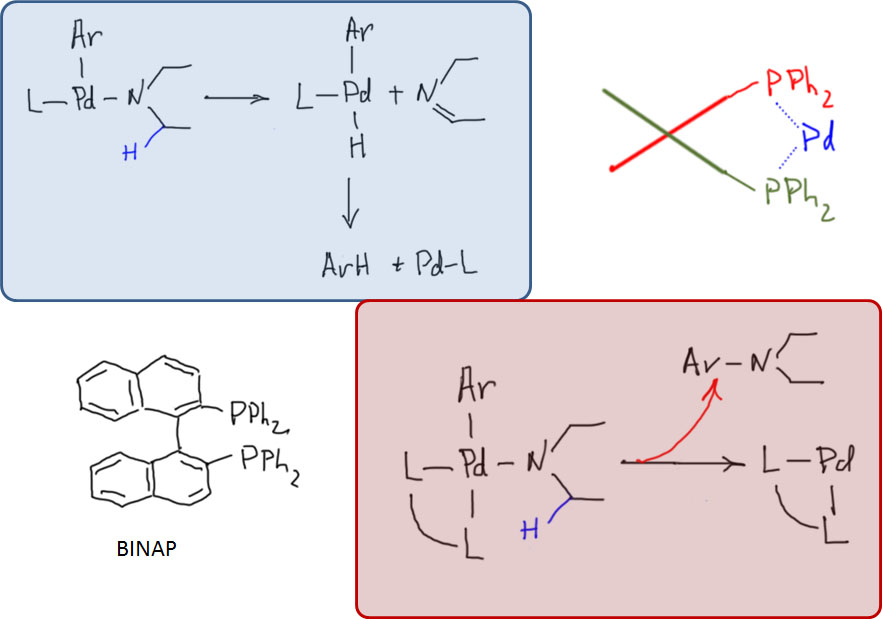
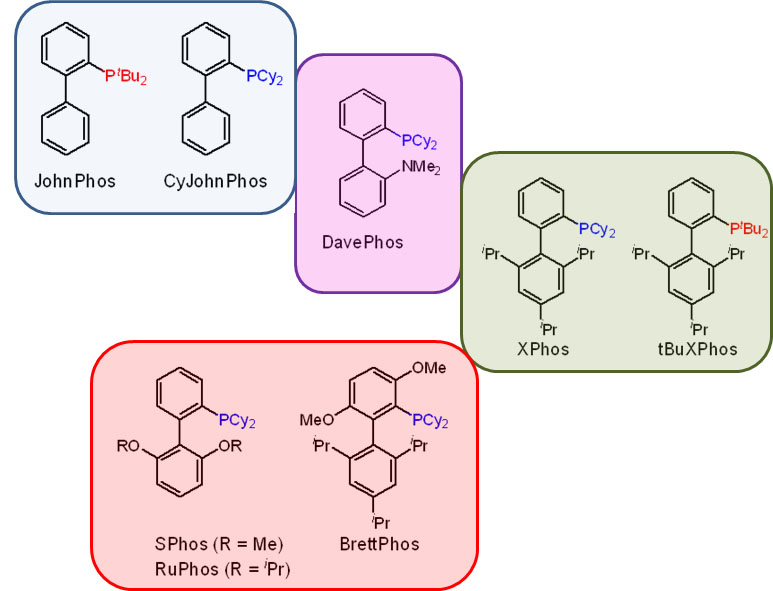
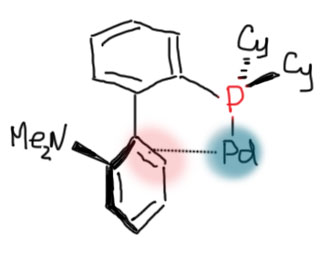
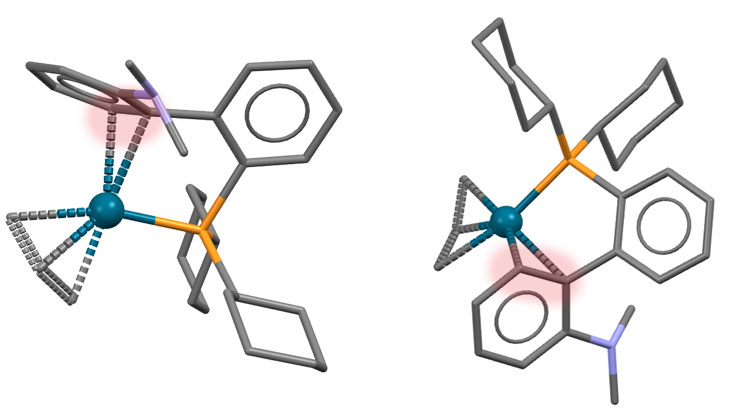
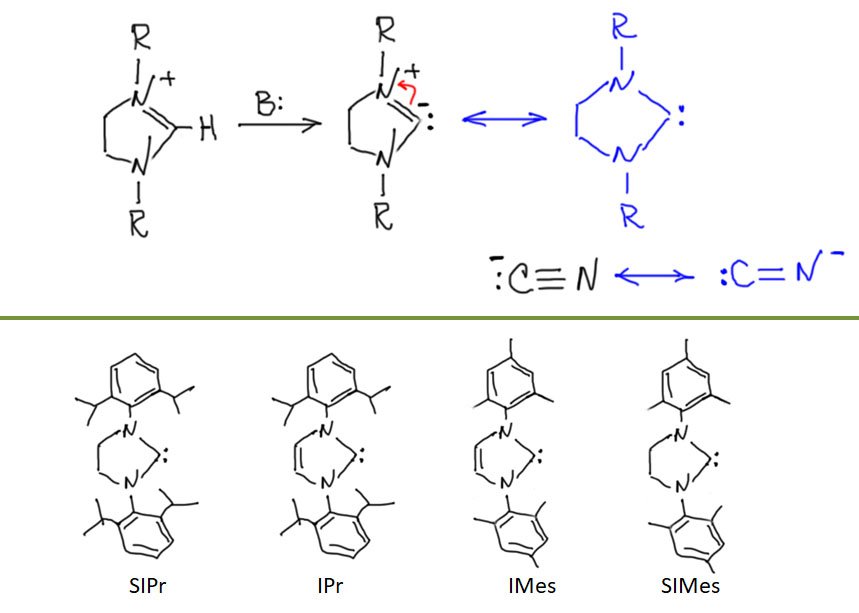
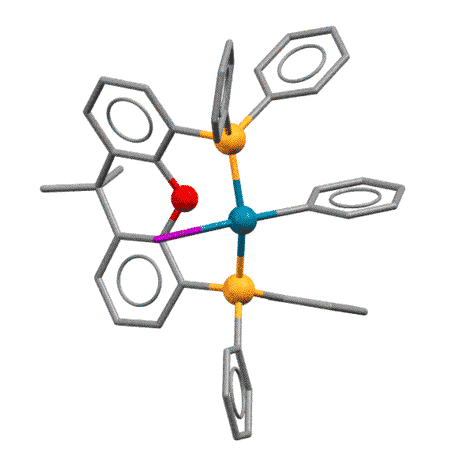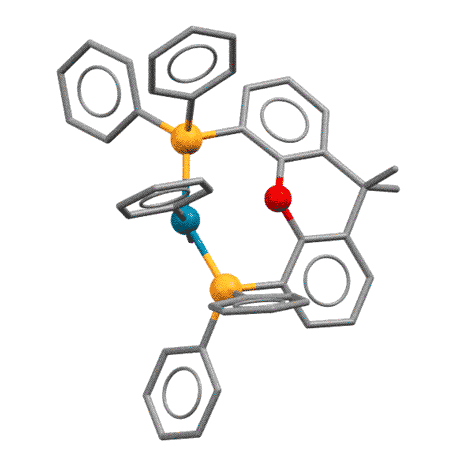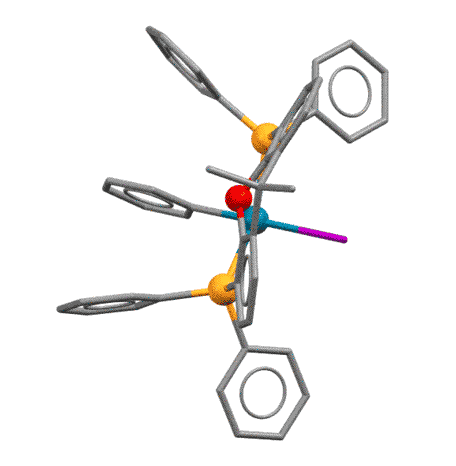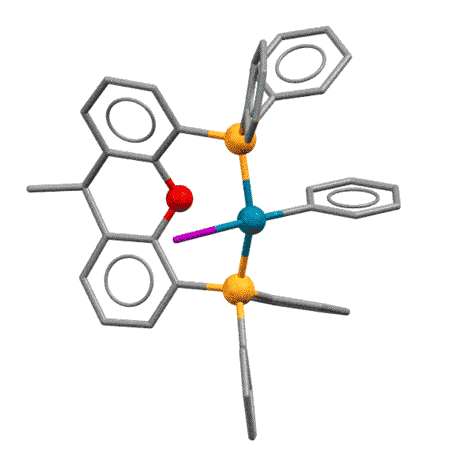
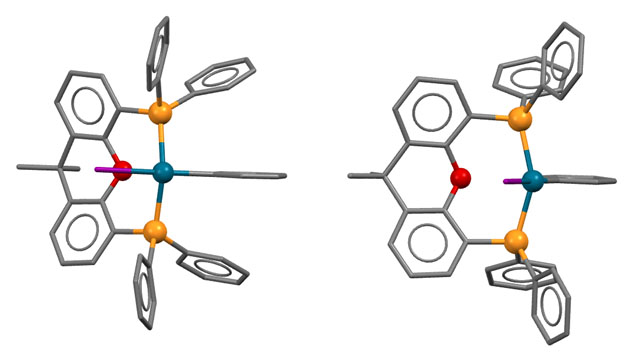
Гораздо интереснее было бы грузить на металл не металлоорганику переметаллированием, а непосредственно сам нуклеофил лигандным обменом. Но, чтобы это стало возможно, требуется гораздо более серьёзный уровень понимания того, как устроен каталитический цикл, и того, как им можно управлять. Ключевой фактор здесь – анциллярный лиганд. В классическом кросс-сочетании анциллярный лиганд в основном просто держит низковалентное состояние переходного металла. Но уже в ранних работах мы видим единичные, но важные примеры более серьёзной работы анциллярного лиганда – например, контроль побочной реакции гидридного элиминирования. В 1980-е и первой половине 1990-х такие данные стали накапливаться, что понемногу привело к идее о том, что нужно серьёзнее взяться за изучение и целенаправленный дизайн лигандов. Возникло понятие “well-defined catalyst” – то есть не просто некая форма переходного металла, которую мы добавляем в реакционную смесь, а дальше – как будет угодно уполномоченным богам. Что там с ним происходит и как, мы конечно, пытаемся понять и нарисовать, но в чисто гипотетическом смысле. Нет, теперь мы хотим знать, что точно происходит в координационной сфере, закрепив ту её часть, которая не используется лигандами-акторами, красивым, координационно совершенно стабильным лигандом или лигандами (второе – реже, координационная сфера ведь не резиновая). Пошло бурное развитие химии дизайнерских лигандов, почти всегда, на первом этапе, хелатирующих. Оправдался ли этот подход и в какой степени, мы увидим дальше.
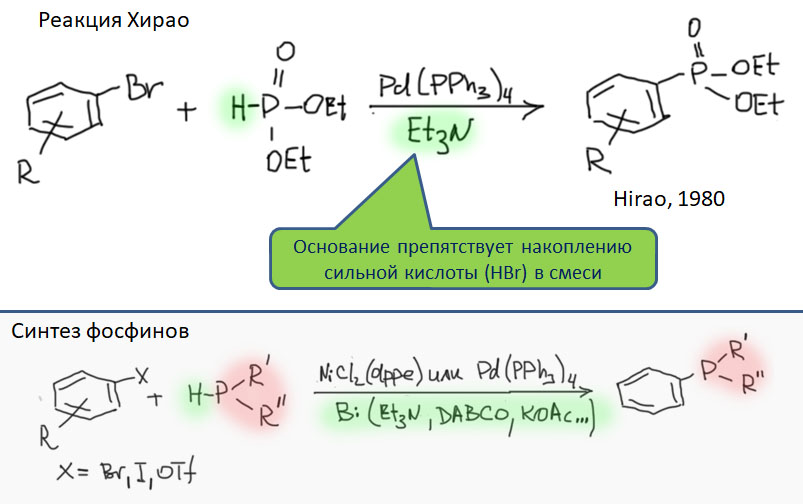
Но начнём мы опять в 1970-х, потому что именно тогда появились две первые реакции, в которых нуклеофил вводится не в виде металлоорганики, а как таковой или в виде сопряжённой кислоты. Это очень специфические реакции, ранний успех которых был обусловлен специфическими свойствами этих нуклеофилов – терминальных ацетиленов и производных трёхвалентного фосфора. Эти особые свойства позволили открыть и запустить в синтез важные методы кросс-сочетания, по способу выполнения и особенностям вполне аналогичные классическим методами кросс-сочетания.
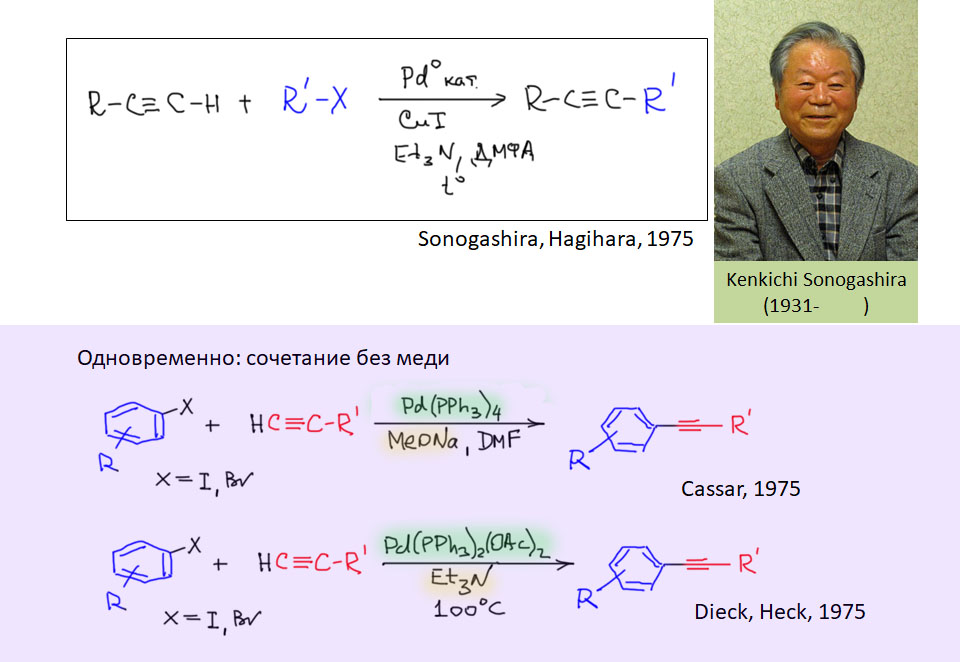
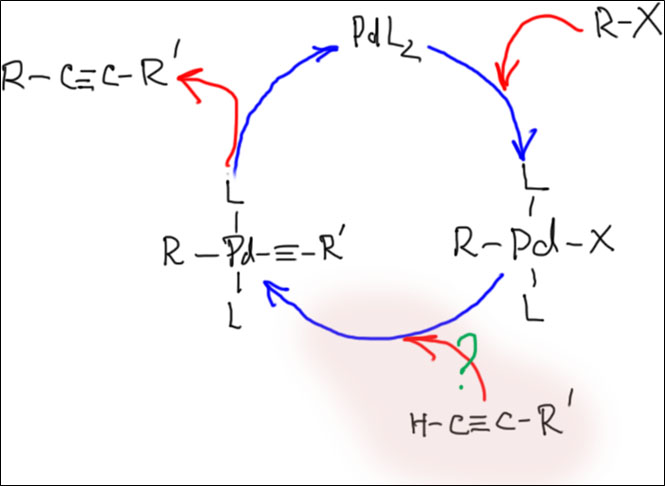
Фактически к Большой четверке классических реакций кросс-сочетания (B, Zn, Sn, Mg) примыкает чрезвычайно важный метод кросс-сочетания с терминальными ацетиленами – реакция Соногасиры или Соногасиры-Хагихары, в которой, по крайней мере формально, в качестве нуклеофила используется не металлоорганическое соединение, а непосредственно нуклеофил – ацетиленид-ион, получаемый прямо в реакционной смеси из терминального ацетилена. На самом деле это не совсем так, и этот метод также основан на реакции переметаллирования, но металлоорганика для переметаллирования получается непосредственно в каталитическом цикле.
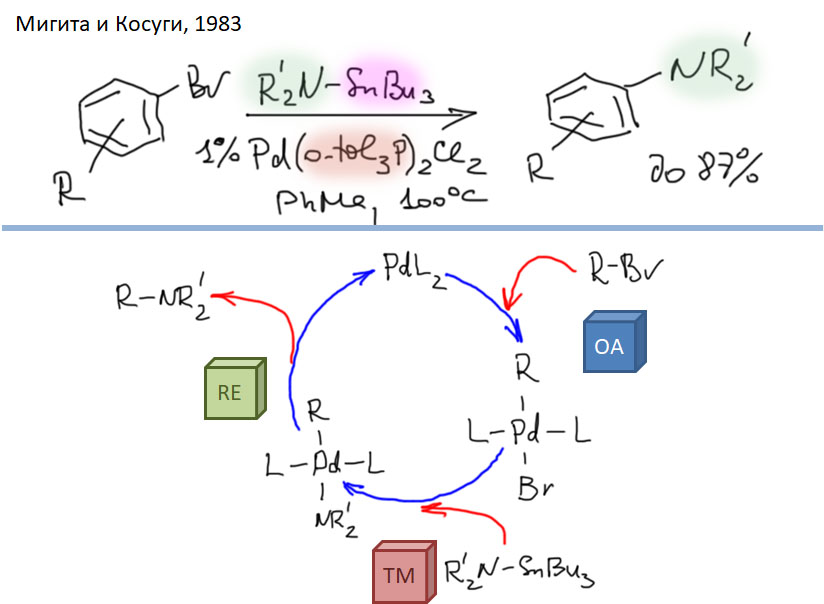
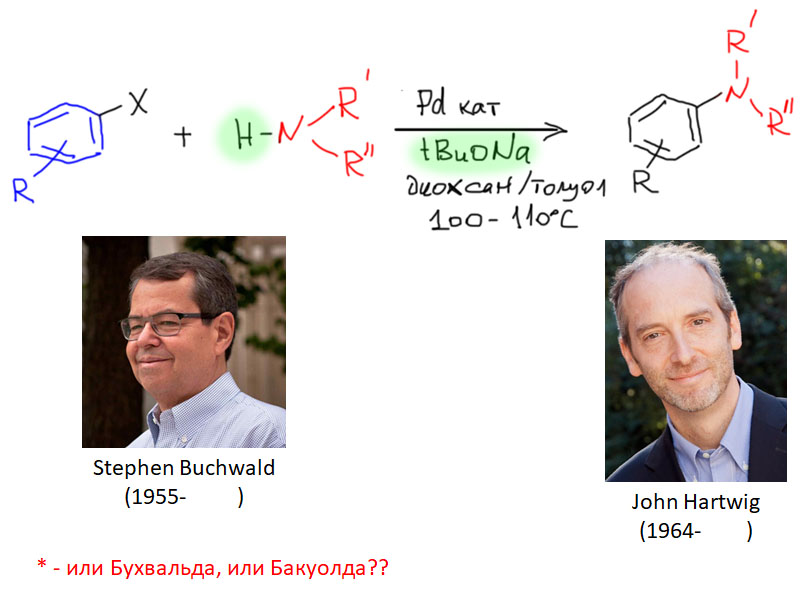
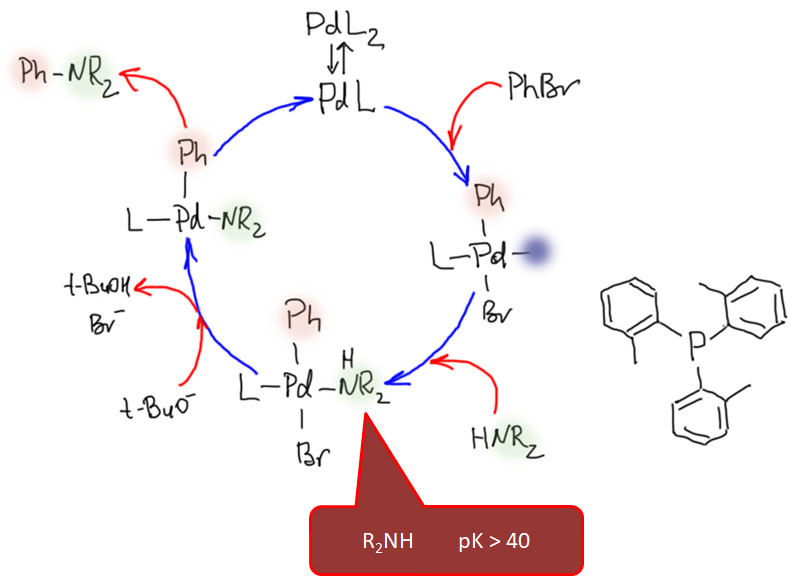
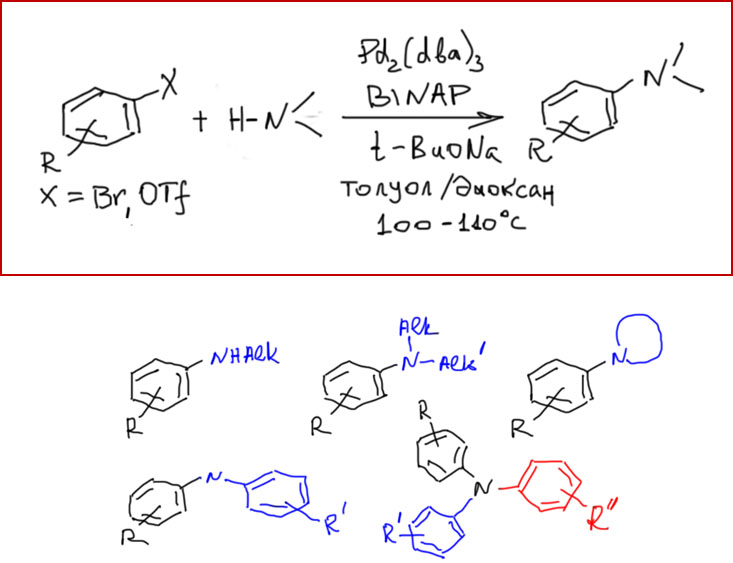
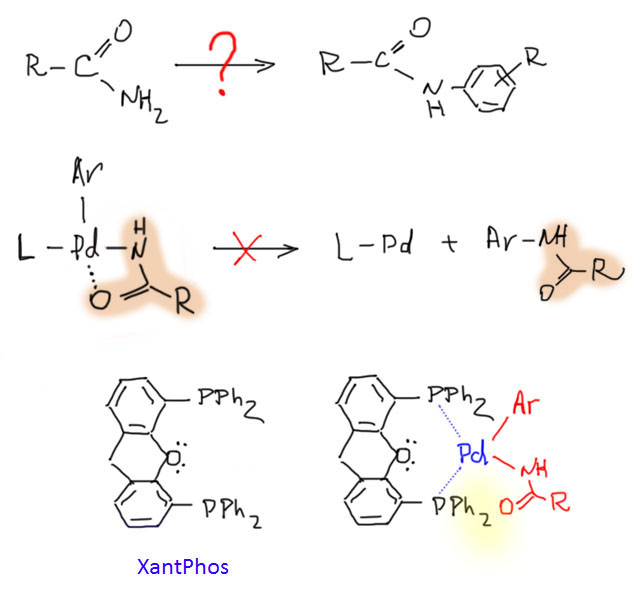
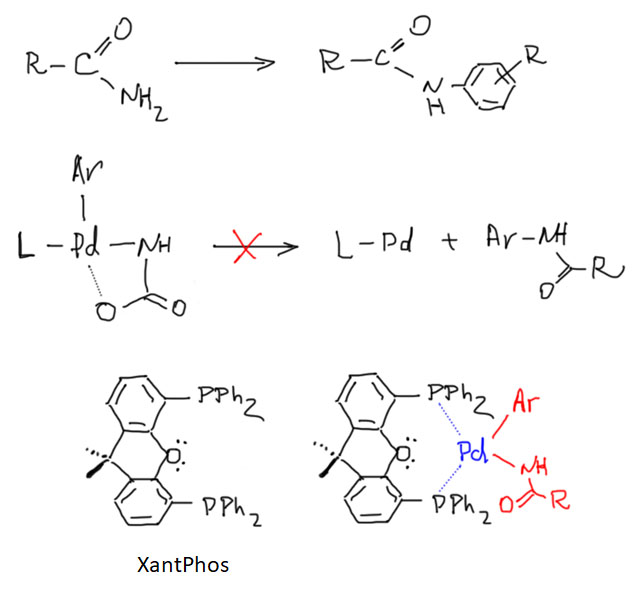
После открытия основных реакций кросс-сочетания – большой пятерки реакций Кумады, Негиси, Стилле, Судзуки, Соногасиры, а также принципиальной возможности применения кросс-сочетания к созданию не только связи C-C, но и связей углерод-неуглерод случилось весьма длительное затишье, когда найденные реакции применяли, совершенствовали, изучали с большим успехом, но новых прорывов не было. Совершенно очевидной следующей задачей стала разработка кросс-сочетания для создания связей углерод-азот. Потребность в действительно мощном и гибком методе синтеза аминов в синтезе ощущалась чрезвычайно сильно. В это время уже начинает развиваться химия молекул, имеющих какие-либо важные функциональные свойства – полупроводников, сенсоров, люминофоров, сенсибилизаторов и т.д., и т.п. – все то, что получило название химии материалов. В русском языке у этого слова есть устойчивая ассоциация со строительством, и услышав это определение мы невольно начинаем думать о кирпичах и штукатурке, и недоуменно моргать. Но это неуместная аллюзия. В английском material – это самое банальное слово, употребляемое просто для обозначения любой полезной вещи, пусть даже и молекулы. Химия полезных молекул – вот что такое material science. Заглянув в любой журнал с таким названием, мы увидим статьи обо всем на свете, лишь бы это было бы хоть чем-то полезно, имело бы какие-то доказанные свойства.
Так вот, среди полезных молекул, то есть материалов множество производных азота, и это, наверное, неудивительно – сама Природа точно не брезгует этим элементом. Молекул много, в том числе таких, которые можно нарисовать на бумаге, а вот методов синтеза производных азота в органическом синтезе было хоть и много, но с огромными пробелами: множество аминов или вообще недоступны методами классической органической химии, либо доступны, но с такими сложностями, что проще не связываться. Потребность в новой химии была огромной.
Вряд ли, поэтому, можно удивиться тому, что именно C-N кросс-сочетание открывает новую главу в кросс-сочетании и вообще в применении комплексов переходных металлов в органической химии. Открытие этой реакции вызвало совершенно бешеный интерес к применению химии переходных металлов, и буквально за 10 лет после её открытия мы увидели огромные достижения – были решены и многие другие задачи, считавшиеся до этого практически нерешаемыми (например, эффективное вовлечение хлорпроизводных в кросс-сочетание и другие реакции).
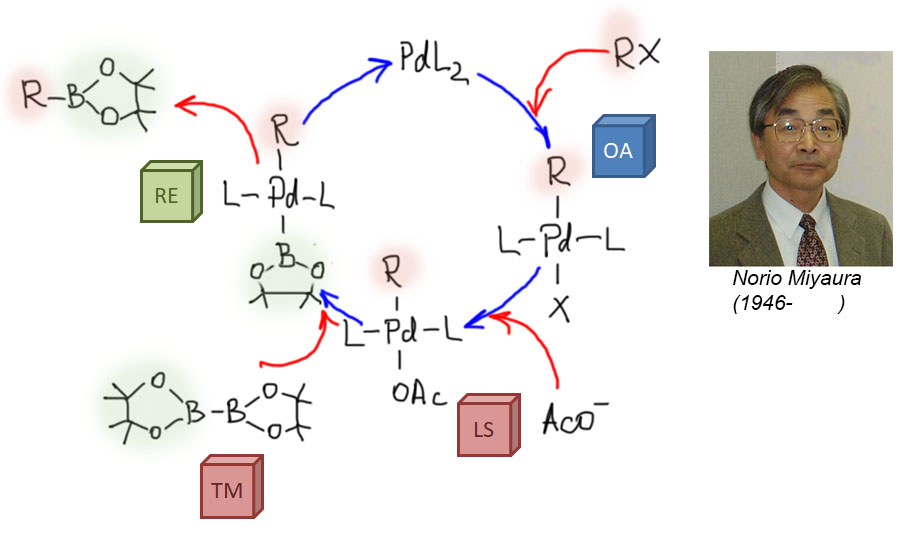
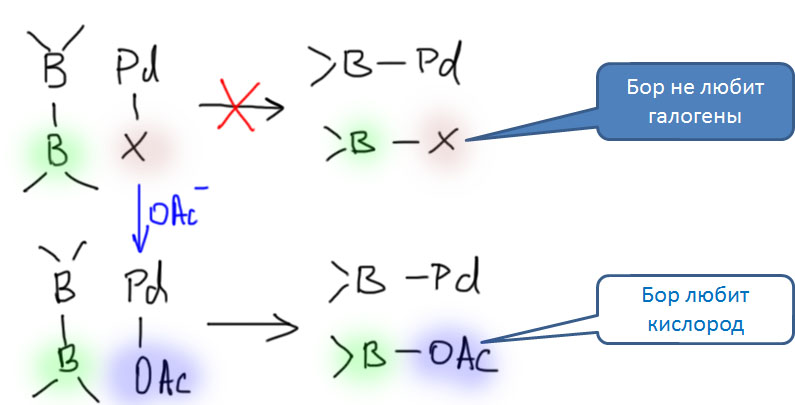
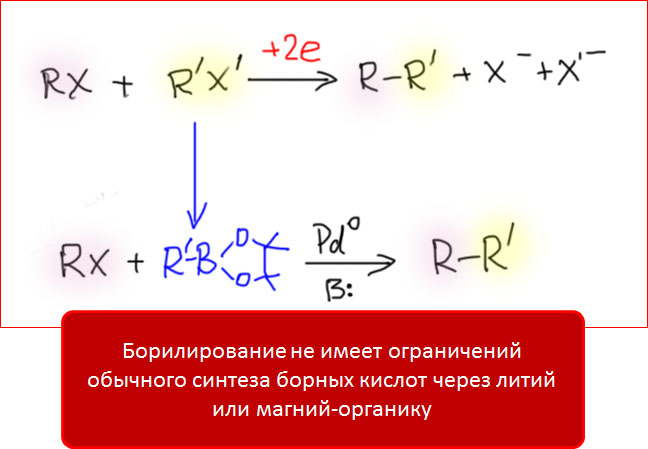
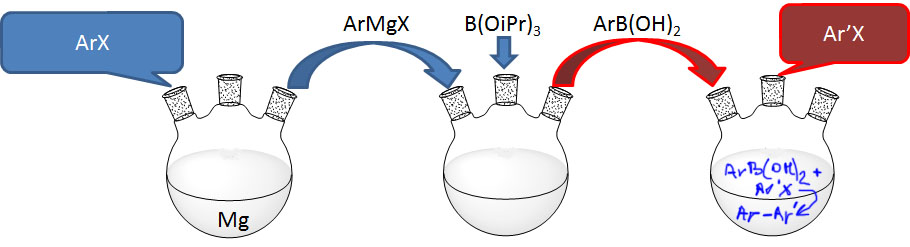
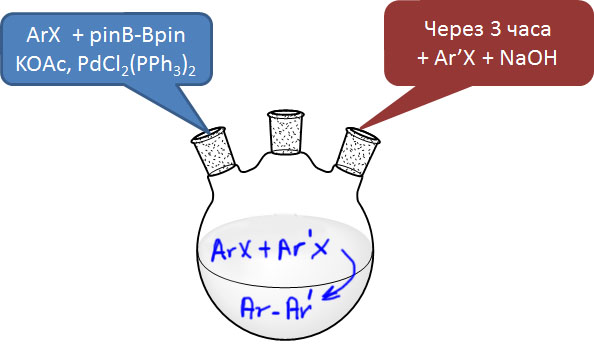
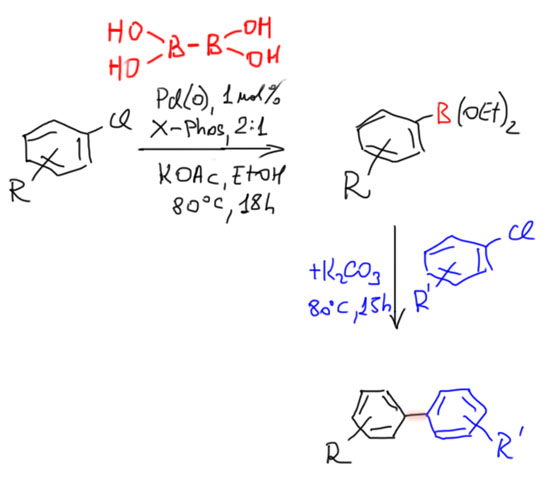
Кроме реакции C-N кросс-сочетания, которая произвела настоящую революцию в синтезе соединений азота, чрезвычайный интерес представляет открытая практически одновременно реакция образования связей углерод-бор, которую принято называть борилированием. Сочетание этой реакции с кросс-сочетанием Судзуки-Мияуры исключительно удобно. и очень сильно расширяет возможности этого метода, фактически открывая дорогу для кросс-сочетания двух разных галогенпроизводных или трифлатов без необходимости предварительного получения борных кислот.
Мы говорим “кросс-сочетание”, подразумеваем “палладий”. Ну, иногда, один раз из ста, ещё никель. Очень долго это было непреложной истиной. Робкие попытки пристроить к делу другие металлы производили комическое впечатление ничтожностью достигаемых результатов. Палладий-катализируемое кросс-сочетание фактически стало устойчивым словосочетанием, в котором невозможно было изменить ни одного слова.
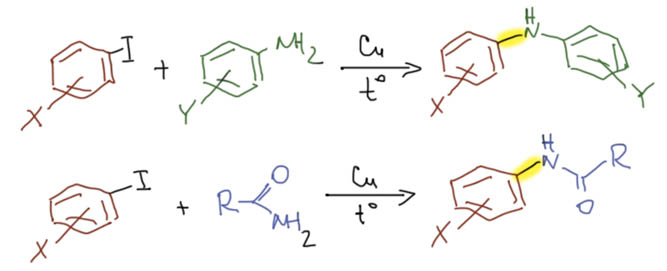
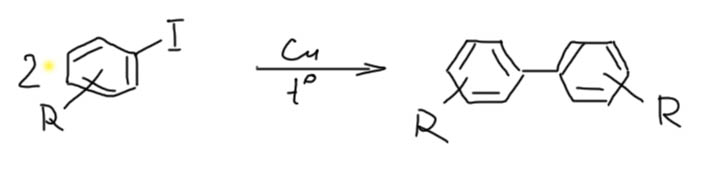
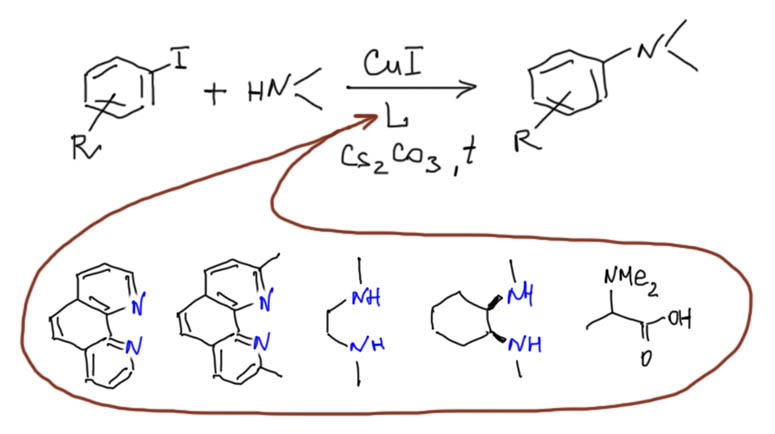
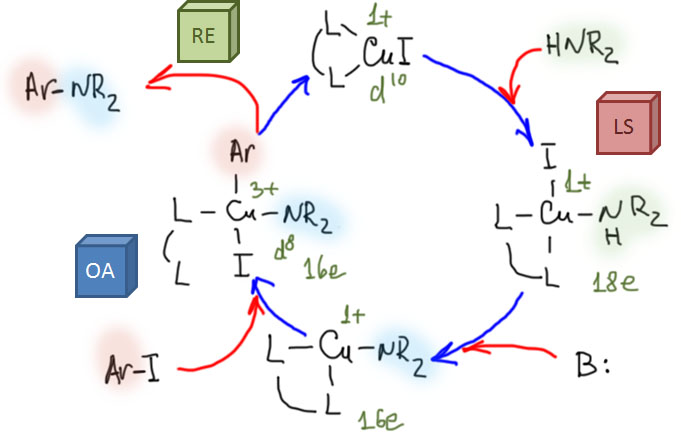
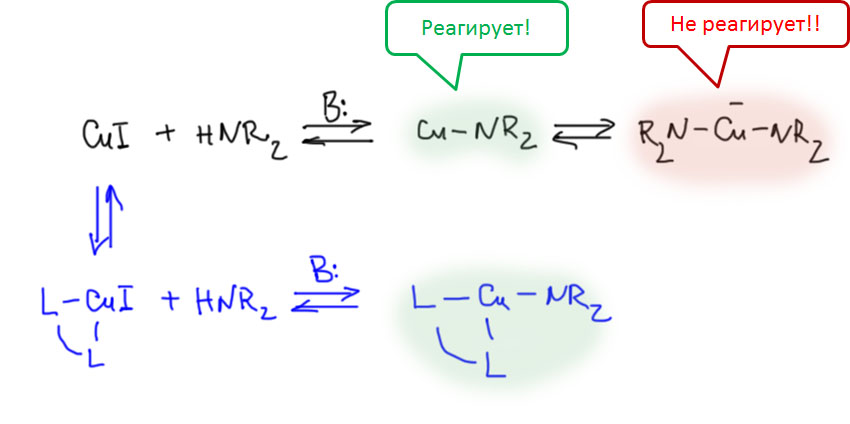
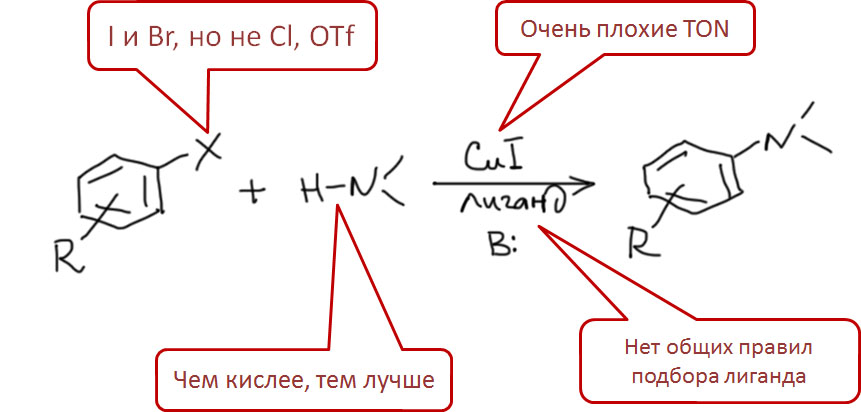
А ведь кросс-сочетание, как мы успели заметить, исторически было связано не с палладием, а с медью. Но в конце 20 века палладий настолько прочно оккупировал эту область, что про медь забыли все. Оказывается, не все. И с середины 1990-х совершенно внезапно начинается возрождение меди в кросс-сочетании. И сейчас, спустя более двух десятилетий, видно, что это было не недоразумением, а устойчивой тенденцией. За это время медный катализ в кросс-сочетании отвоевал себе настолько впечатляющий кусок этой химии, что больше говорить о монополии палладия решится только тот, кто совершенно утратил связь с современными достижениями в химии. Более того, как любят говорить вояки, “на плечах” меди в область вторглись и другие металлы, и сейчас в кросс-сочетании шумит совершенно удивительный и красочный карнавал множества металлов и их не менее живописных комплексов. Где ты, прекрасное далёко, когда всё было так ясно и понятно, что можно и что нельзя, и какой метод применить, а куда вообще не соваться? Сейчас можно всё, но вопрос как упирается в то, насколько мы верим в сотни новых протоколов катализа, практически не проверенных реальным синтезом. Поживём, попробуем, увидим.
Поэтому, так далеко мы пока в это углубляться не будем, но про медь вспомним…