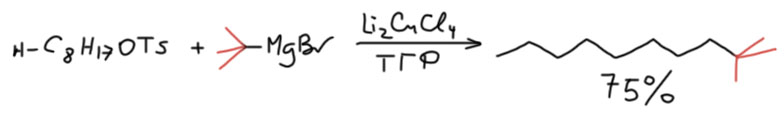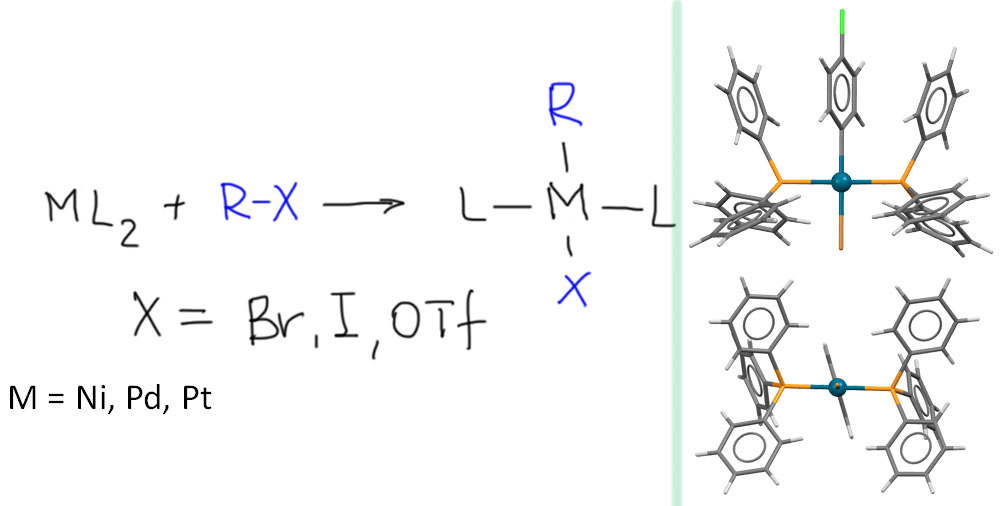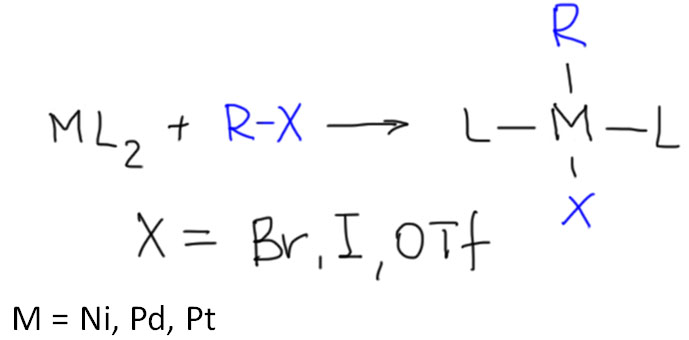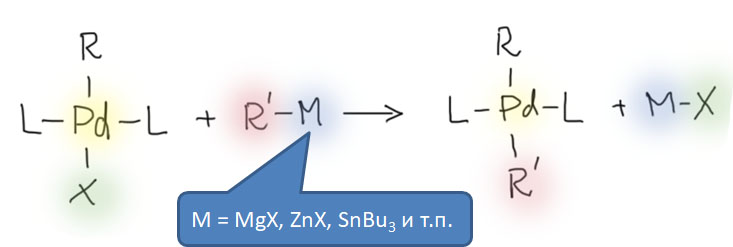Классическое кросс-сочетание.
После того как мы разобрались с основными реакциями, которые обеспечивают участие органических электрофилов и нуклеофилов в реакциях комплексов переходных металлов, приступим к изучению собственно процессов кросс-сочетания. В этой лекции посмотрим на реакции, которые были открыты первыми, в 1970-х, и стали классикой современного органического синтеза. Введение этих методов в методологию органического синтеза позволило эффективно и надежно решить старую проблему – как соединить разные органические фрагменты в новую молекулу. Большинство сложных органических молекул можно одним или многими способами разделить на более простые фрагменты, и очень часто это деление можно повторить уже с этими фрагментами, и так далее: довольно очевидно, что таким образом можно построить эффективный алгоритм синтеза даже очень сложных структур. В математике и программировании такой подход сильно напоминает бинарный алгоритм поиска – если у вас есть огромный массив данных, то искать в нем что-то конкретное перебором всех элементов долго и неэффективно. Вместо этого массив делят на две части, каждую из них еще на две части и так далее – это очень быстро приводит к очень небольшим кусочкам, искать в которых легко и просто. В математике для успеха этого алгоритма данные должны быть отсортированы. В химии, когда мы делим молекулу, которую нужно синтезировать, на части, мы тоже руководствуемся вполне ясными представлениями о взаимном влиянии групп, относительной совместимости реакционных центров и т.п. – и так сортируем фрагменты по сочетаемости. Выглядит такой подход очень привлекательно, и потому что делит сложную задачу на более простые части, некоторые из которых часто даже не приходится синтезировать, а можно просто взять с полки или купить в магазине, и потому что общий выход целевого продукта в этом случае избегает страшного проклятия – любое число меньше 1 (даже 0.99), возведенное в большую положительную степень, это очень малое число, стремящееся к нулю. Именно так ведет себя целевой выход линейного многостадийного синтеза – чтобы получить миллиграммы, начинать приходится с килограммов.
Все замечательно, но до открытия методов кросс-сочетания и некоторых других методов, использующих комплексы переходных металлов, в органическом синтезе не было таких универсальных подходов. Совершенно неудивительно, что органики просто чрезвычайно обрадовались изобретению методов кросс-сочетания, а органический синтез стал решать все более сложные задачи. Удивительно, впрочем, что это произошло далеко не сразу, и массированное внедрение кросс-сочетания в органический синтеза началось только в 1980-х. Кросс-сочетание удостоилось Нобелевской премии только в 2010 году (спустя более 40 лет после начала работ в этом направлении) не в последнюю очередь из-за правил премии, не допускающей к раздаче более трех лауреатов, при том, что к разработке методов кросс-сочетания имели отношение никак не менее дюжины крупных ученых. Нобелевскому комитету пришлось терпеливо ждать, когда по естественным причинам число претендентов не станет совместимым с правилами.
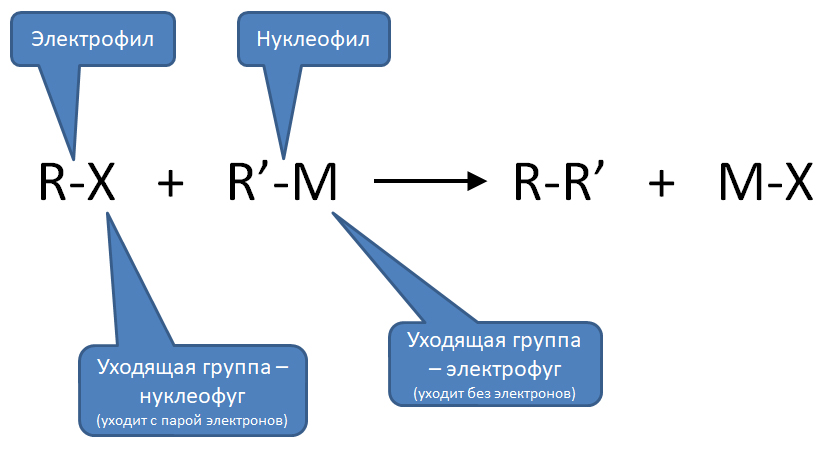
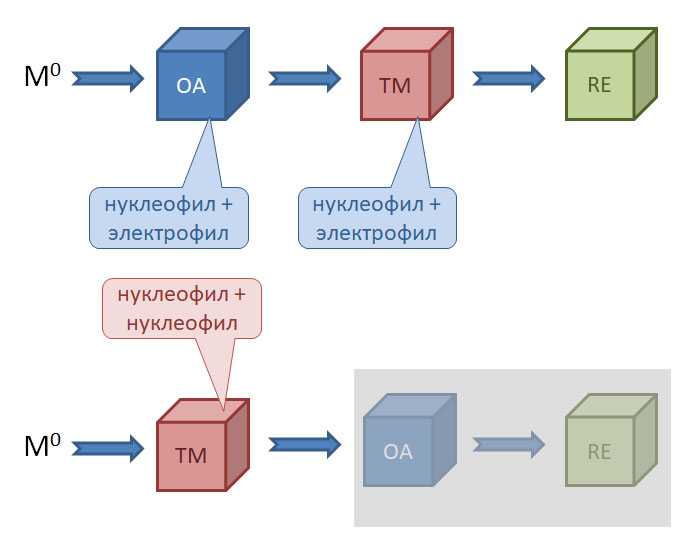
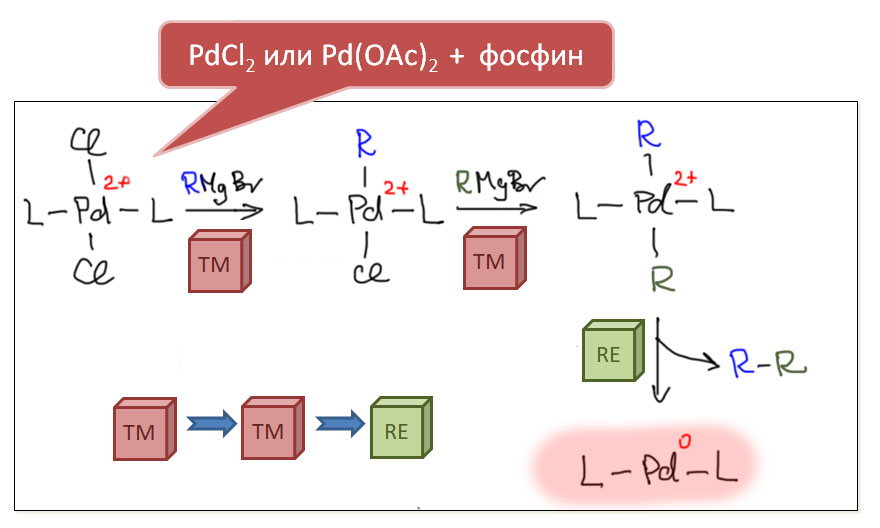
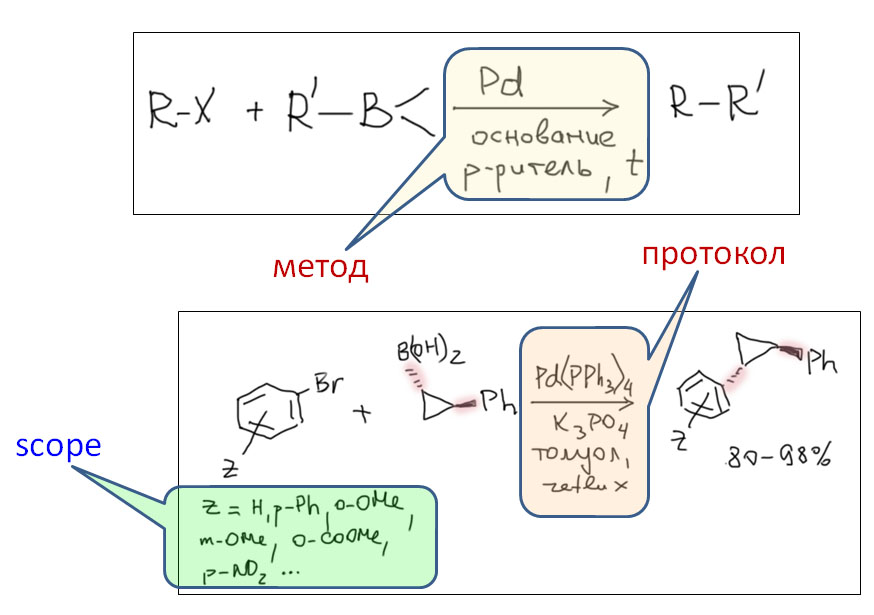
Начнём с общего описания классического кросс-сочетания. Под этим термином мы будем объединять методы, основанные на последовательности стадий
сначала электрофил потом нуклеофил
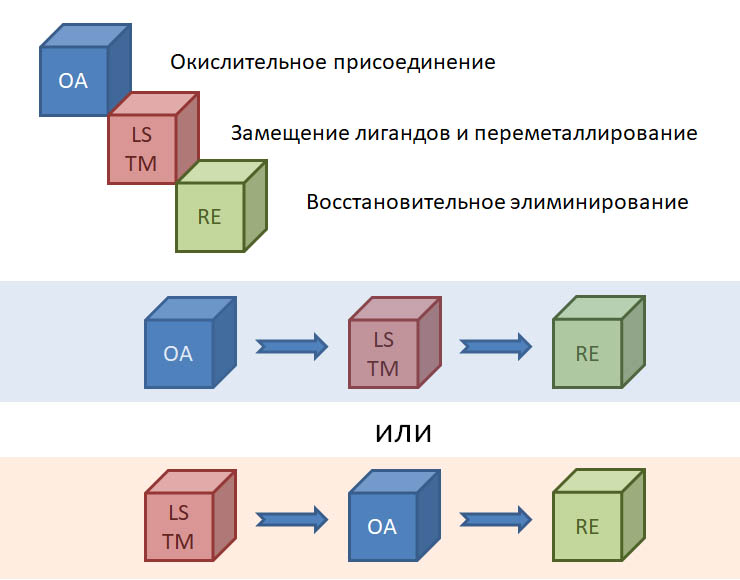
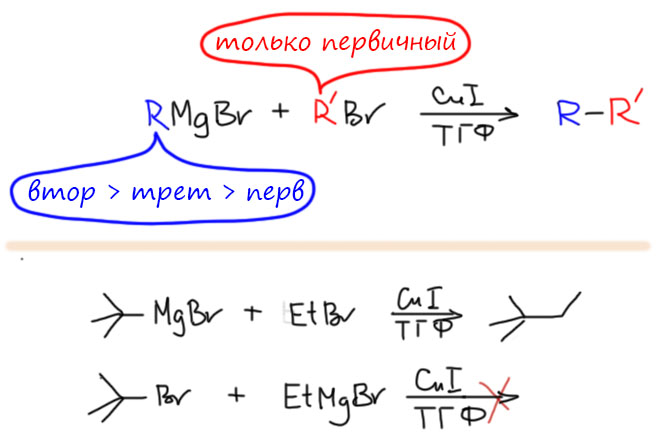
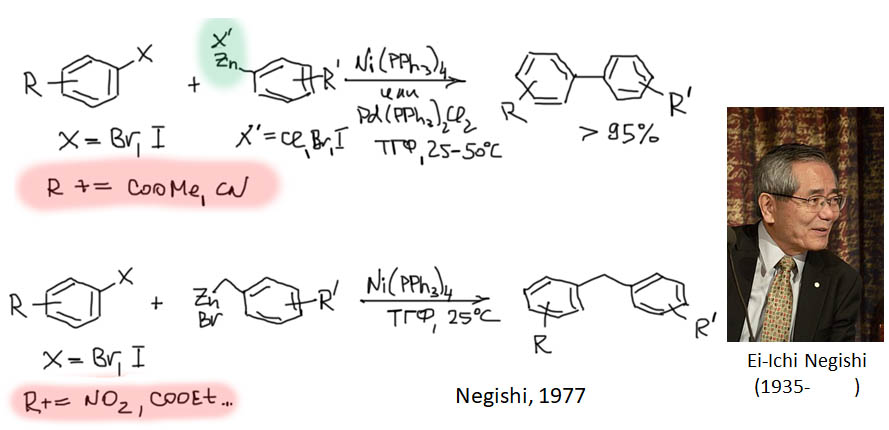
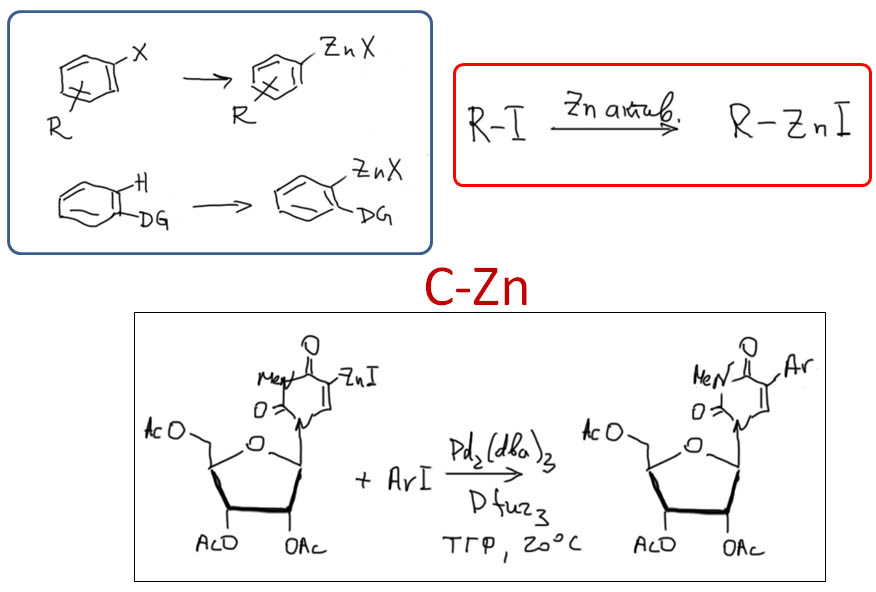
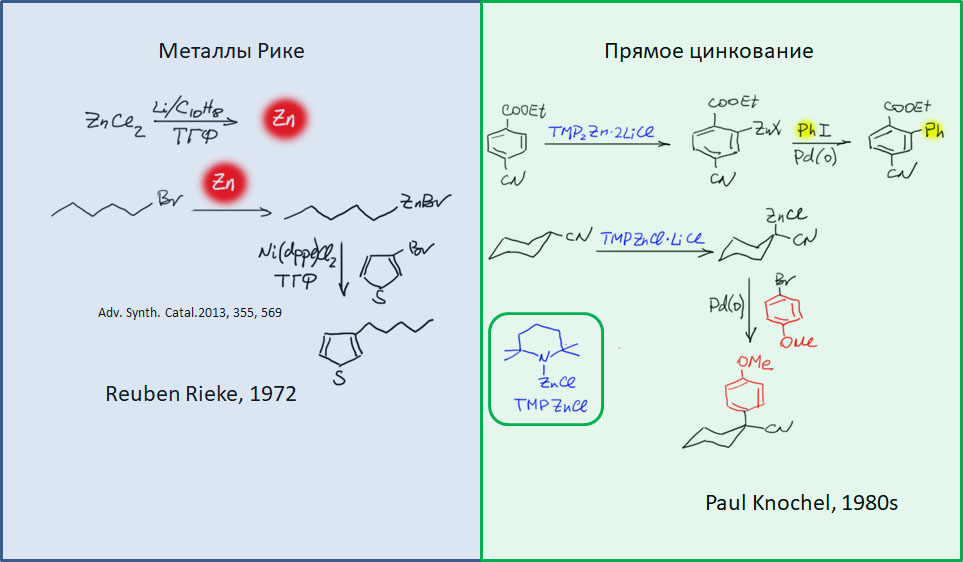
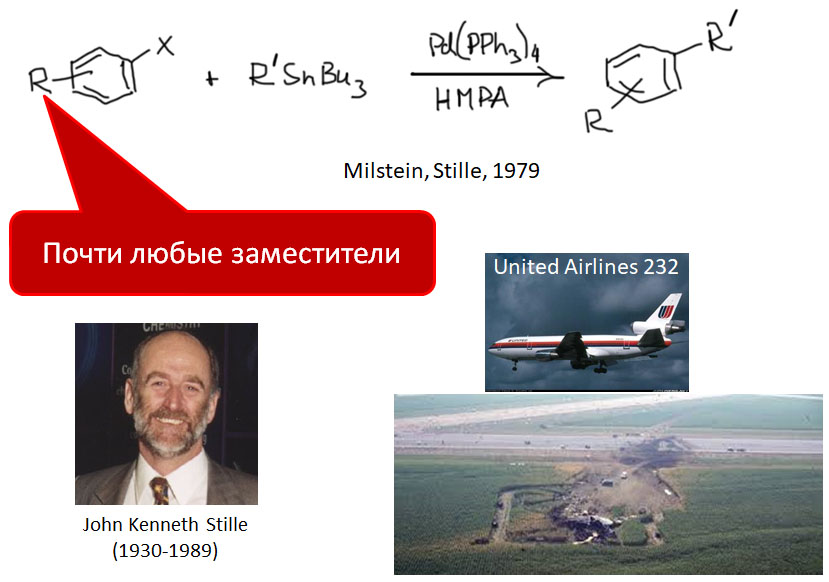
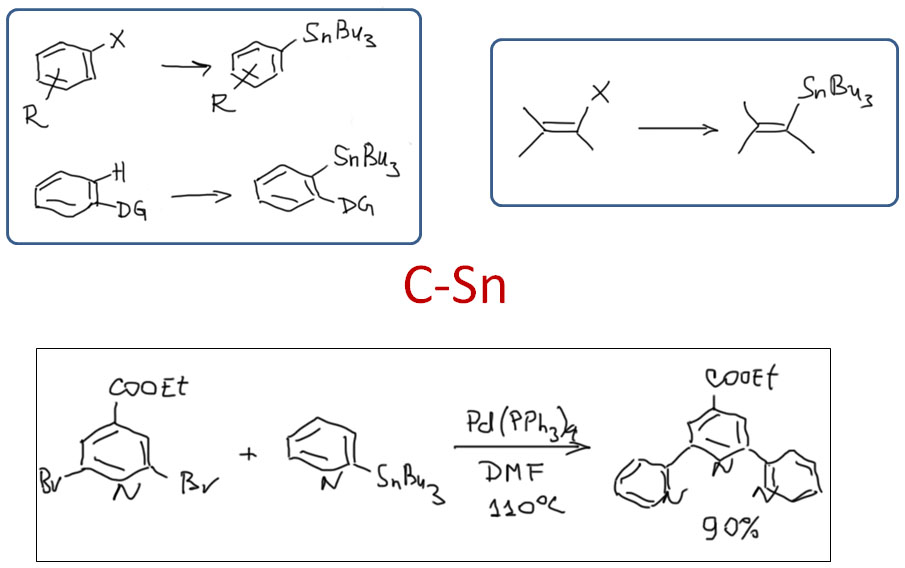
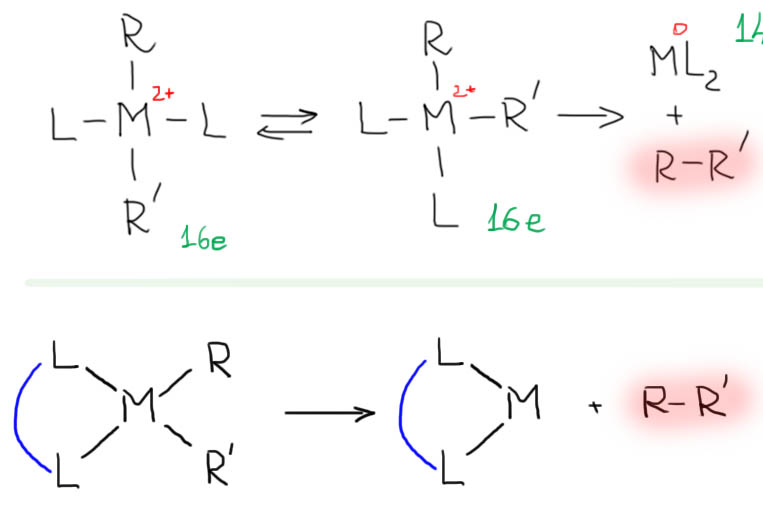
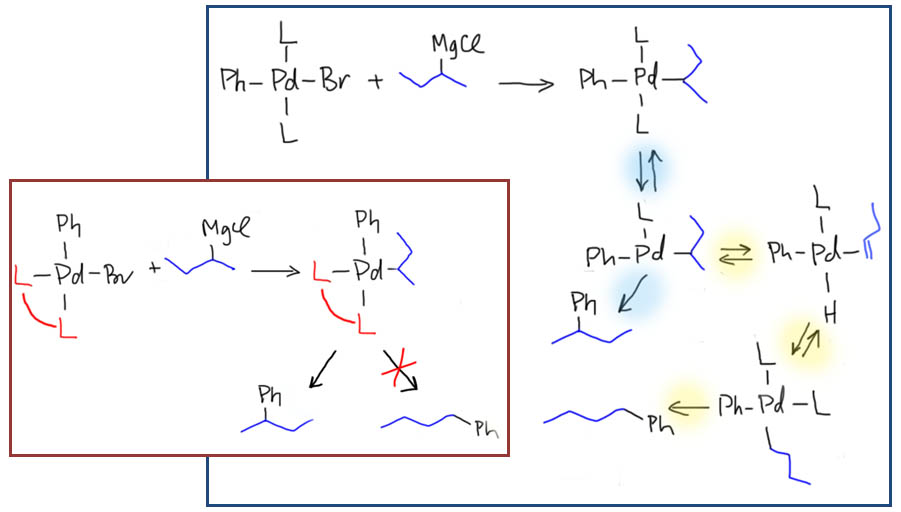
причём электрофил вводится окислительным присоединением, а нуклеофил – обязательно переметаллированием из металлоорганического соединения с недостаточной реакционной способностью для прямой, некаталитической реакции с электрофилом. Для реакции кросс-сочетания на её начальном этапе пробовались самые различные металлы, но большинство не оправдало ожиданий и было забыто, некоторые не навсегда. В первый ряд выдвинулись магний, цинк, олово, позволяющие осуществить кросс-сочетание в присутствии никелевых или палладиевых катализаторов, но без необходимых дополнительных реагентов. С них и начнём.
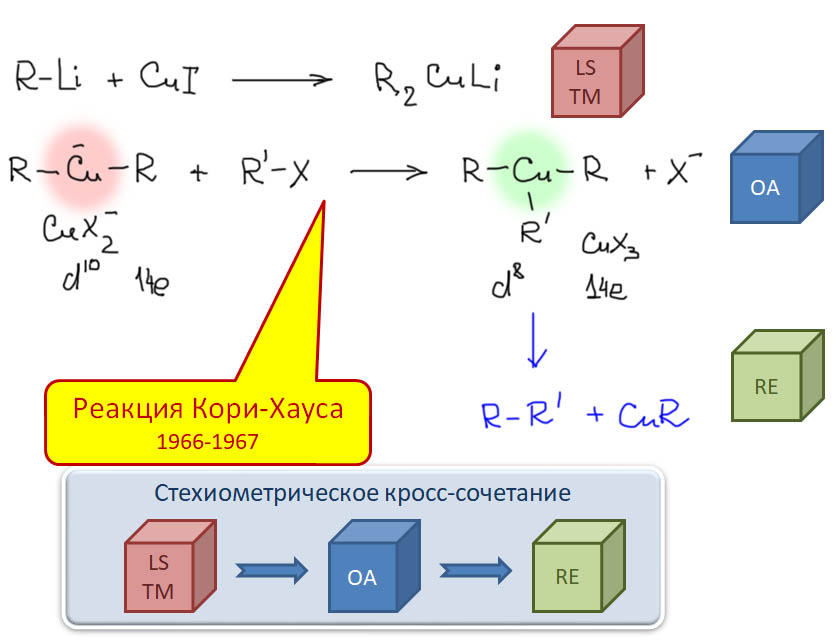
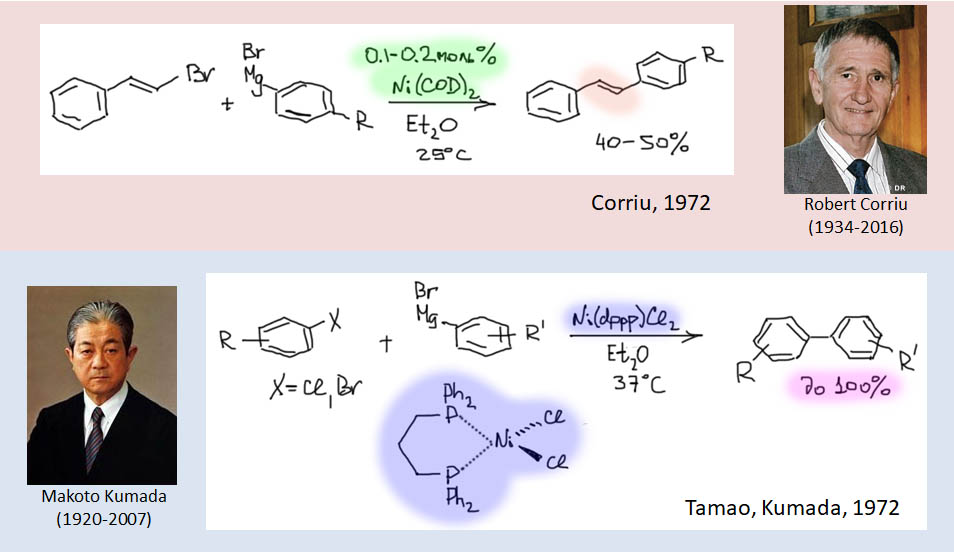
Классические каталитические реакции кросс-сочетания основаны на использовании комплексов двух элементов 10 группы – никеля и палладия с явным количественным и качественным преимуществом последнего. Комплексы никеля остаются важными, но нишевыми катализаторами, отлично справляющимися с рядом важных реакций (например, в реакции Кумады-Тамао-Коррью никель имеет статус основного, а палладий – только запасного игрока), но проигрывающими по универсальности, охвату, селективности, и прочим важнейшим параметрам. Со своей стороны у никеля только одно бесспорное преимущество – цена. Палладий еще не так давно был одним из самых дешевых платиновых металлов, но фантастические успехи этого элемента в катализе вознесли его в цене выше золота и платины. По сравнению с палладием, даже во времена относительной дешевизны последнего, никель – совершенно бросовый ресурс. Стоит понимать, что в масштабах всей экономики это не так: никель – это ценнейший, стратегический цветной металл, но масштабы использования соединений элемента в химии и катализе относительно невелики, и в таких масштабах, где речь идет не о сотнях и тысячах тонн, а о граммах, его цена действительно пренебрежимо мала. Интересно, что третий металл 10 группы, платина совершенно бесполезна в кросс-сочетании. В органическом синтезе в целом у платины и ее комплексов есть своя, и весьма незаурядная роль и мы это еще увидим. Но – не в кросс-сочетании. При этом, у платины есть все типы основных реакций, входящих в кросс-сочетание – и окислительное присоединение, и переметаллирование, и восстановительное элиминирование вполне аналогичны таковым у палладия и никеля, но относительная скорость этих процессов не позволяет сшить их в одну последовательность. В результате на комплексах платины часто моделировали отдельные стадии кросс-сочетания, но не весь процесс в целом.
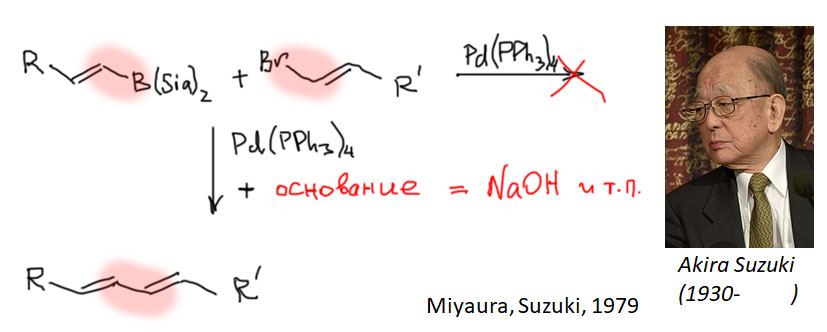
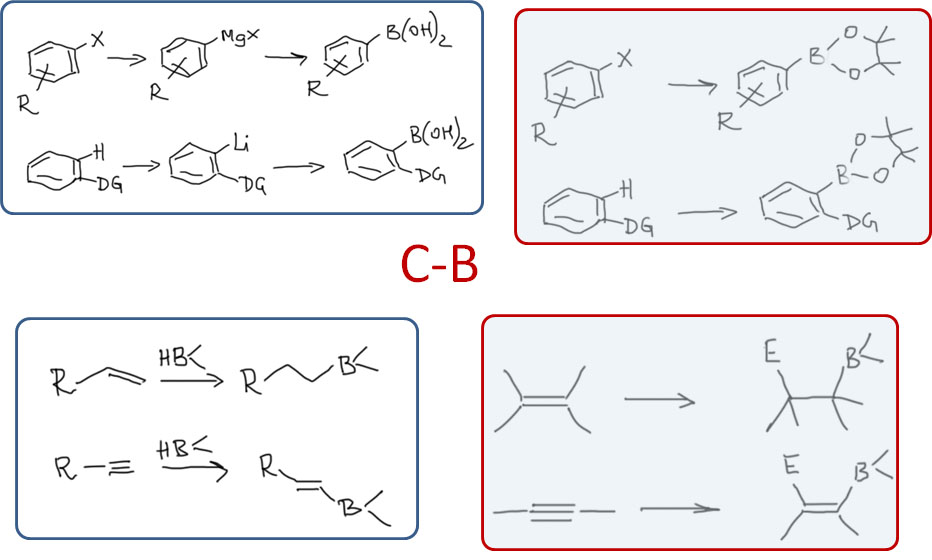
Ещё одним важнейшим достижением кросс-сочетания стала возможность использования совсем слабых органических нуклеофилов, производных даже не металлов, а металлоидов, в первую очередь, бора, во вторую – кремния. Связь углерод-бор настолько неполярна, что ввести её в реакции не удавалось и даже считалось почти невозможным (хотя мы знаем, что борорганика реагирует с такими электрофилами, как акцепторы Михаэля). Но очень простой приём делает борорганику способной реагировать в рамках классического кросс-сочетания, включая переметаллирование. Это открытие можно считать одним из самых фундаментальных в химии кросс-сочетания, а реакция с бороорганикой – реакция Судзуки-Мияуры – стала бесспорным лидером в этой области и остаётся до сих пор, а претендентов на этот пост не видно. Именно поэтому мы и рассматриваем эту реакцию отдельно от первой тройки – магний-цинк-олово.