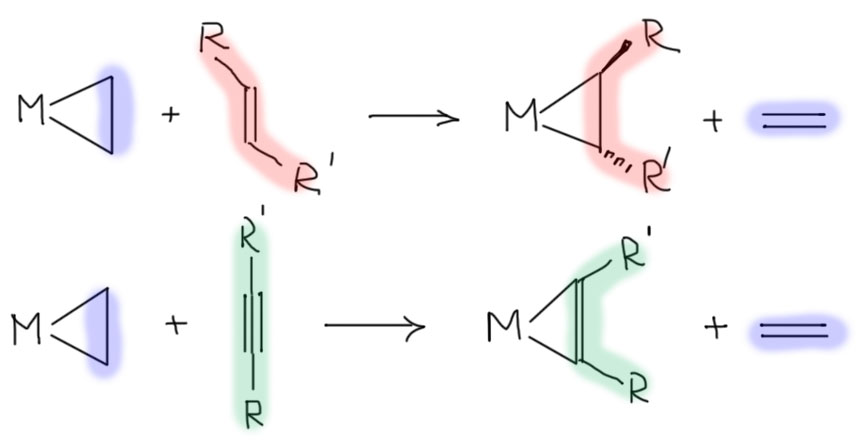
Металлациклопропаны и металлациклопропены
Комплексы с очень большой долей обратного донорного эффекта
Если вклад back-donation очень велик, мы получаем очень интересную ситуацию. Перенос электронной плотности с металла на пи-связь можно мысленно рассмотреть, представив себе, что было бы, если электрон перенесется полностью. Ничего страшного в этом нет, вспомним, что мы делали то же самое, когда обсуждали окислительное присоединение – электрон с металла на сигма-связь разрушал ее, буквально разорвав на радикал и анион, которые становились двумя X-лигандами в координационной сфере металла. Вот и здесь получится нечто очень похожее. Только сигма-связь при этом остается, удерживая половинки вместе.
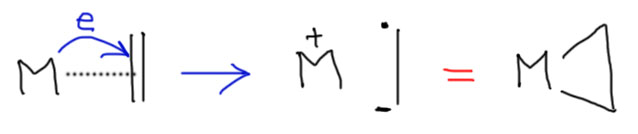
То, что мы видим похоже уже не на дигапто-комплекс, а на трехчленный цикл с атомом металла в цикле – металлацикл, даже можно точнее сказать, металлациклопропан. Обратите внимание на букву а – именно а, а не о – такая буква в номенклатуре означает, что есть какая-то структура, скажем, циклопропан, а один из атомов углерода в этой структуре заменен на то, что идёт перед буквой а. Эпоксиды по этому правилу можно было бы назвать оксациклопропаны. Пиридин – азабензолом. Диэтиловый эфир – 3-оксапентаном. И т.п.
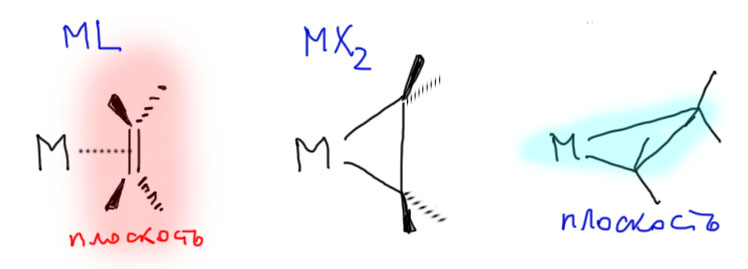
Но тогда получается, что такой процесс привел бы к изменению степени окисления металла, потому что в обычном комплексе металл-олефин олефин – это L-лиганд, а в металлациклопропане – уже два X-лиганда, структурный тип становится MX2, и степень окисления меняется на +2. Другими очевидными следствиями являются изменения гибридизации оставшихся углеродов с sp2 на sp3 с изменением геометрии олефинового фрагмента с плоской на типичную для связи C(sp3)-C(sp3).
С ацетиленами произойдет похожая история – будет комплекс, который можно назвать металлациклопропеном, произойдет изменение гибридизации углеродов и заместители на атомах углерода отогнутся в сторону от металла.
Комплексы такого типа встречаются относительно намного реже “нормальных” дигапто-комплексов, но они очень интересны. Легко найти такие комплексы в 4 группе среди соединений титана, циркония, гафния. Эти металлы связывают олефины и ацетилены из валентного состояния M(2+) с оболочкой d2. Но будучи типичнейшими представителями ранних переходных металлов, они предпочитают пустую d-оболочку. Сдать два электрона как раз и можно таким образом. Обратите внимание, что мы обычно не учитываем back-donation в подсчете электронов, степени окисления и всех остальных формальных вещей. Но в этом случае, проявление этого эффекта настолько велико, что можно смело говорить об изменении природы лиганда, и вместо взаимодействия металл(2+)-олефин (или ацетилен) рассматривать взаимодействие металл(4+)-дианион. Фактически мы можем даже не заморачиваться с back-donation, а просто сначала мысленно перенести два электрона с металла на кратную связь, и считать, что комплекс образуется не из исходного металла в степени окисления +2 и олефина или ацетилена, а из металла в степени окисления +4 и дианиона олефина или ацетилена – то есть дикарбаниона.
Выглядит страшно? Но это ведь именно то, что мы и так рассматриваем как интермедиат, например, в восстановлении ацетиленов раствором щелочных металлов в жидком аммиаке. Так что, в принципе, и здесь есть аналогия с химией непереходных металлов. Обратите только внимание на эту принципиальнейшую разницу – то, что у непереходных металлов происходит как отдельная реакция между двумя реагентами (олефином или ацетиленом и источником электронов), в химии переходных металлов происходит внутри комплекса не как процесс, а как образование связей между центральным металлом и атомами лиганда.
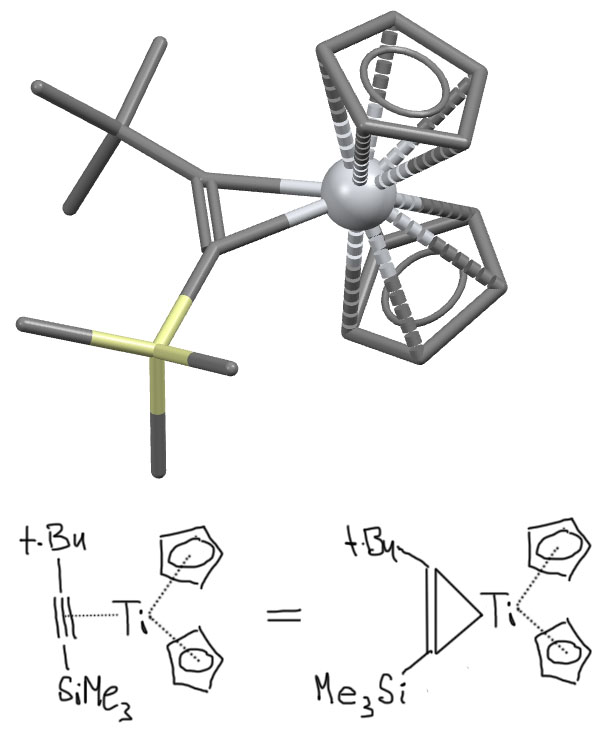
Вот пара реальных примеров. Комплекс титаноцена с трет-бутилтриметилсилилацетиленом (U. Rosenthal et al., Journal of Organometallic Chemistry 501 (1995) 179-188) совершенно явно выглядит не как комплекс с линейным ацетиленом, а действительно как титанациклопропен. Заместители на бывшем ацетилене отогнуты – гибридизация совершенно явно изменилась на sp2.
А вот комплекс циркония с дифенилацетиленом (E.-I.Negishi J. Am. Chem. Soc. 1989, 111 , 3336-3346). Опять от ацетилена не осталось ничего, фенилы отогнуты в сторону, гибридизация изменилась – налицо цирконациклопропен.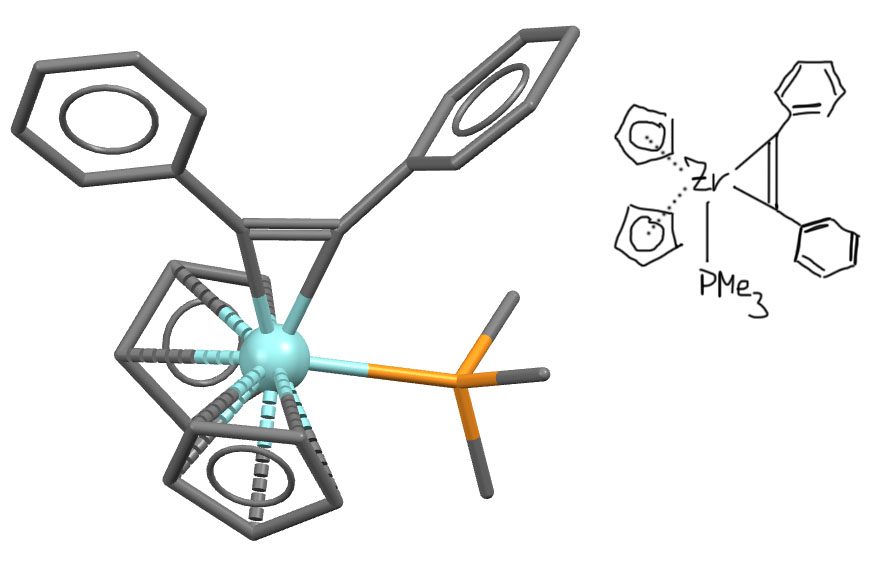
Есть, правда, один нюанс. Когда мы говорим “металлациклопропан”, “металлациклопропен” мы не должны буквально воспринимать это как структурные аналоги настоящих циклопропана и циклопропена. Металл в этих комплексах находится на значительном расстоянии от атомов углерода (2.1 – 2.3 Å), поэтому эти циклы – не равносторонние или почти равносторонние треугольники с углами при вершинах около 60º, а скорее такие сильно вытянутые в сторону металла равнобедренные треугольники с углами при углеродных вершинах приближающихся к 75º, а это означает и гораздо меньшее напряжение, и другую электронную структуру. При этом угол у атома металла (угол C-Zr-C и C-Ti-C) составляет несуразно малые 35º или около того. Нет и не может быть химических связей, столь близко расположенных в пространстве! Из курса органической химии мы помним, что у циклопропана угол 60º, и это приводит к тому, что реальная электронная плотность (а также орбитали) в молекуле циклопропана располагается вне прямых, соединяющих атомы, что достигается за счет регибридизации (обсуждение этого можно найти на моем органическом сайте orgchem.avchem.ru). В этом случае также придется поискать более адекватный способ связывания, чем простые и вроде бы выглядящие как σ-связи металл-углерод, потому что именно это мы вкладываем в объяснение структур структурным типом MX2. Пока мы дальше не пойдем, потому что это потребовало бы квантово-химического описания связывания в этих комплексах, но просто отложим в памяти, что здесь все не просто интересно, а, скорее всего, даже еще интереснее.
Тем не менее, с точки зрения реакционной способности металлациклопропаны и -циклопропены ведут себя не только как цикл с двумя связями металл-углерод с значительной степенью ионности и карбанионным характером углеродов, но и как нормальный комплекс металла с олефином или ацетиленом, в частности достаточно часто происходит обмен лигандов, и так в координационной сфере можно заменить один олефин другим, или олефин на ацетилен.
Очень важно, что связь металл-углерод в этом случае будет в значительной степени ионной, очень похожей на связь в металлоорганических соединениях непереходных металлов, а углерод будет иметь значительный вклад карбанионной формы и быть активным нуклеофилом.
Комплексы металлов 4 группы
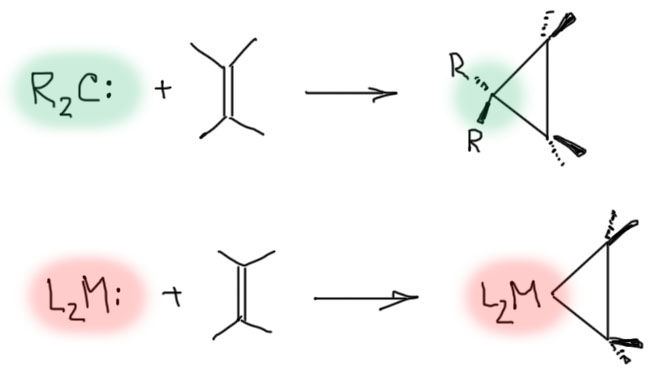
Прямой путь синтеза таких комплексов из комплексов металлов M(2+), например, металлоценов и олефинов или ацетиленов вполне хорошо известен, но требует перехвата образующихся комплексов, потому что иначе они реагируют с дополнительными молекулами олефина или ацетилена – так и начинается полимеризация. Интересно, что комплексы M(2+) типа титаноцена или цирконоцена часто сравнивают с карбенами, и не без основания, так как эти два d-электрона как раз и образуют пару электронов, как у карбенов. А пустая орбиталь у металла точно есть. Получается точно такой же дуализм, как у карбена – молекула и с парой и с пустой орбиталью, и электрофил, и нуклеофил одновременно. Но тогда взаимодействие таких комплексов с алкеном – соблазнительно близкий аналог реакции циклопропанирования из обычной органической химии – реакции карбена с двойной связью. Такое металлациклопропанирование ![]() :
:
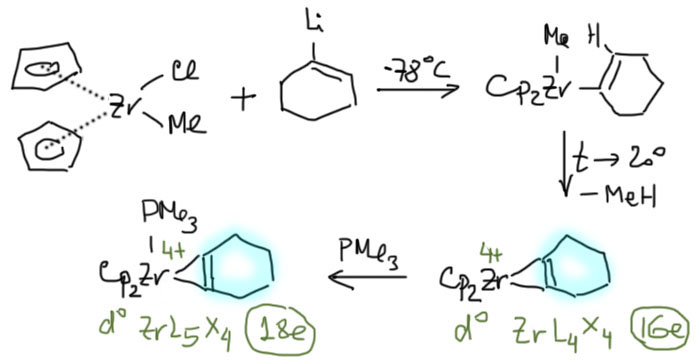
Но чаще используют непрямой путь, предполагающий загрузку двух алкилов или алкила и фенила (алкенила) на металл простым замещением лиганда, после чего один из алкилов отваливает, забирая с собой водород, оставляя в координационной сфере искомый лиганд – это реакция внутрисферного бета- элиминирования, весьма характерная для комплексов ранних переходных металлов, в отличие от бета-гидридного элиминирования, более характерного для поздних. Один алкил (метил) уже может быть в координационной сфере заранее, как в легкодоступном комплексе цирконоцена Cp2Zr(Me)Cl. Так получают комплексы с алкинами (металлациклопропены), в том числе дегидробензолами и циклоалкинами. Обратите внимание на то, что, например, циклогексин неустойчив и не может быть получен, а комплекс циклогексина – пожалуйста, ведь в нем больше нет тройной связи и проблем с ужасным угловым напряжением. Только нужно добавить еще один донорный лиганд, чтобы получить устойчивый координационно насыщенный комплекс. Чаще всего использьзуют комплексы циркония, но и титан с гафнием ведет себя так же.
Комплексы с дегидробензолами тоже хорошо известны и изучены и далеко не только с ранними переходными металлами.

Вот как, например, устроен комплекс, показанный на схеме (S.L.Buchwald et al, J. Am. Chem. Soc., 1986, 108, 7411). С комплексами дегидробензола есть одна проблема – просто разглядывая структуру с опущенными атомами водорода, непросто сразу понять, действительно ли это комплекс такого же типа, как комплексы с настоящими ацетиленами, а не просто обычный комплекс с лигандом L-типа. Но если немного подумать, то если бы это был не бензин, а настоящий бензол, у него на этих атомах углерода оставались бы атомы водорода и металл не смог бы его подцепить так – строго сбоку, в плоскости кольца. Ему пришлось бы подкатить так немного бочком, снизу или сверху, и структура была бы другой. Да и реакции этого комплекса полностью аналогичны реакциям цирконациклопропеновых комплексов (см. следующий раздел).
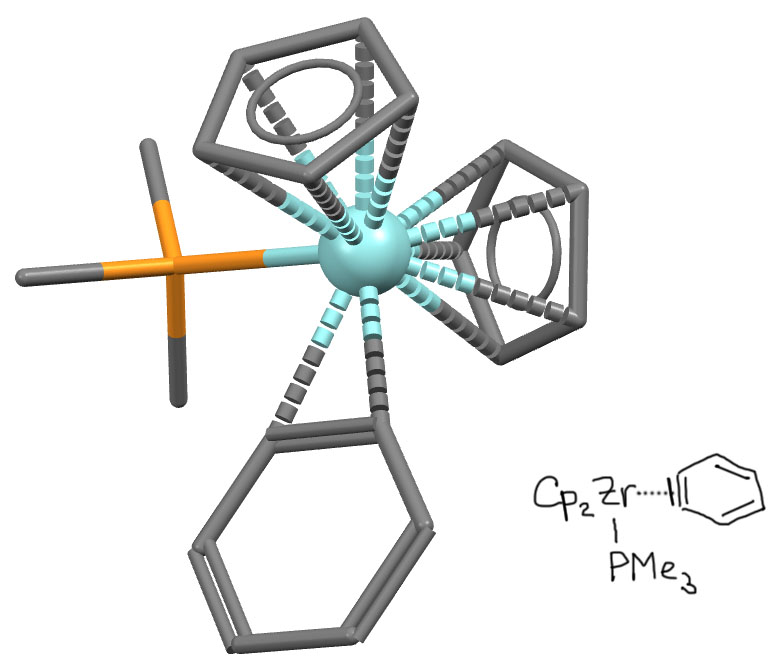 Еще несколько примеров комплексов дегидробензола. Комплекс с танталом (Cp* – общепринятое сокращение очень популярного донорного лиганда пентаметилциклопентадиенил)(M.R.Churchill, Inorganic Chemistry, 1979, 18, 1697) – водороды показаны:
Еще несколько примеров комплексов дегидробензола. Комплекс с танталом (Cp* – общепринятое сокращение очень популярного донорного лиганда пентаметилциклопентадиенил)(M.R.Churchill, Inorganic Chemistry, 1979, 18, 1697) – водороды показаны:
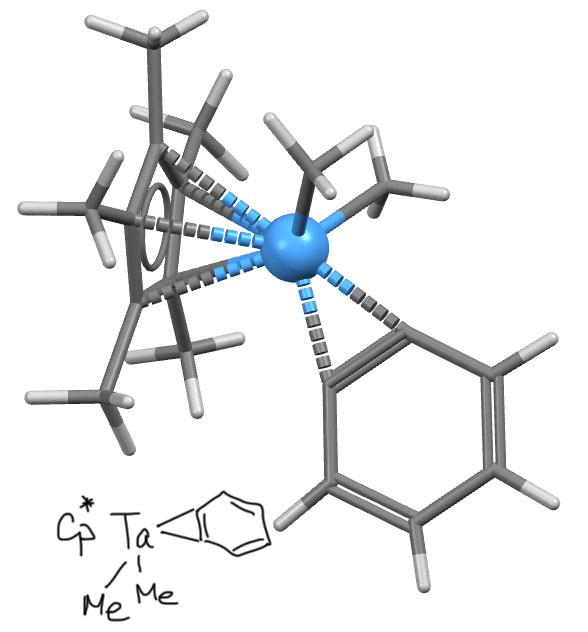
Комплекс никеля (Bennett et al, Organometallics 1985, 4, 1992-2000) – водороды скрыты
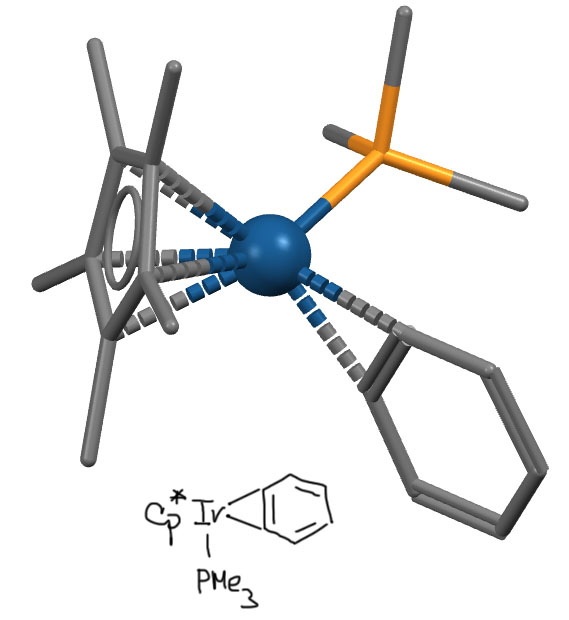
Комплекс иридия (R.P. Hughes, Organometallics 2002, 21, 4873-4885)
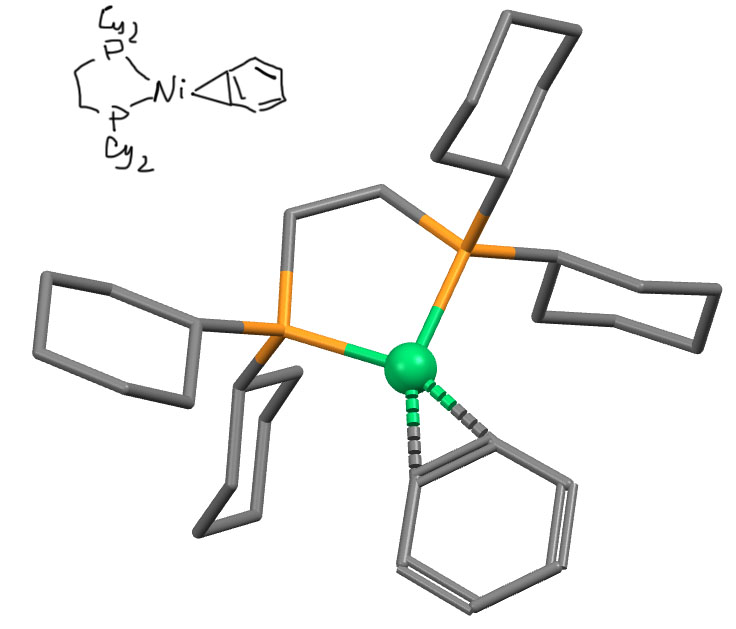
И даже палладия (E. Wenger et al, J. Am. Chem. Soc. 2002, 124, 8348-8360)
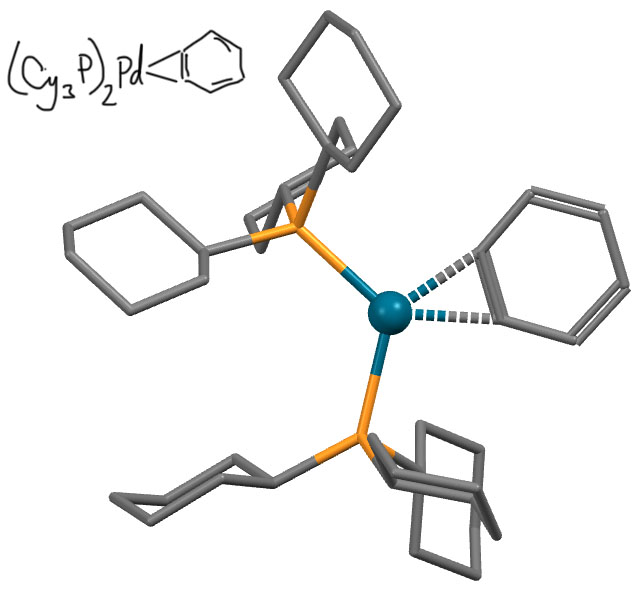
Реакционная способность металлациклопропанов и металлациклопропенов
Связь металл-углерод, как мы уже выяснили, в значительной степени ионная, и углерод ведет себя как сильный нуклеофил, очень похоже на, например, углерод рядом с магнием в реактивах Гриньяра. Поэтому эти комплексы отлично реагируют с полным набором органических электрофилов – альдегидами, кетонами, нитрилами, другими производными кислот и т.п. Образующийся аддукт ждет гидролиза. Любопытно, что в случае комплексов дегидробензолов с орто-заметителем получается продукт замещения в удаленном от заместителя положении. Это страшно напоминает известную историю с образованием мета-изомеров из орто-галогенпроизводных при нуклеофильном замещении по ариновому механизму. Но – здесь направление реакции совсем не зависит от электронных эффектов заместителя, и связан, скорее всего, со стерическими факторами.
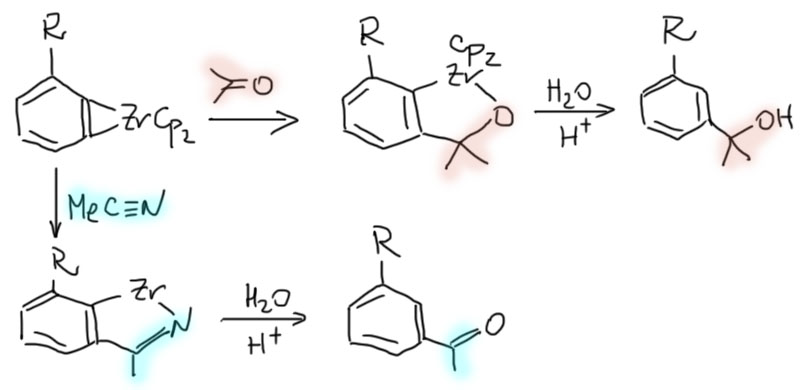
Эти реакции очень интересны, но они не являются каталитическими и требуют 1 эквивалента цирконоцена. Но есть и каталитические реакции, включающие превращения металлациклопропанов. Одна из самых интересных – синтез циклопропанолов по Кулинковичу.
Реакция Кулинковича
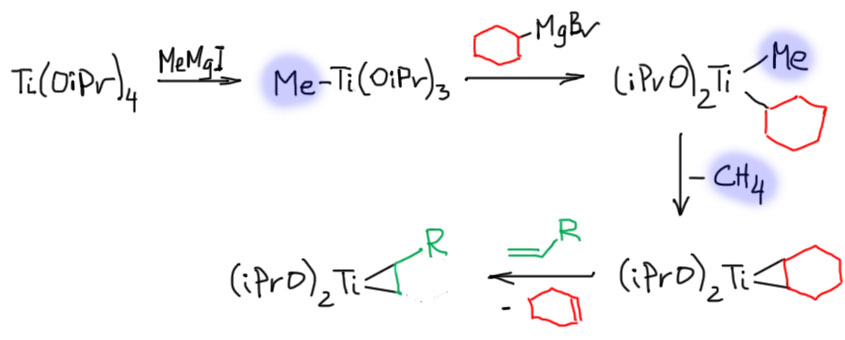
В 1989 беларусский химик O.Кулинкович описал удивительную по изяществу реакцию образования циклопропанолов из сложных эфиров и этилмагнийбромида (Kulinkovich, O. G.; Sviridov, S. V.; Vasilevskii, D. A. Synthesis, 1991, 23, 234). Мы отлично знаем, что эти соединения и так отлично реагируют, образуя третичные спирты. Кулинкович нашел, что если в реакционной смеси присутствует, даже в каталитических количествах, простой комплекс титана тетракис(изопропилокси)титан, то фактически получается почти то же самое – третичный спирт, только одна из молекул реактива Гриньяра превращается в этан, забирая один протон, а вторая – дает два углерода в циклопропановом кольце. Если написать две реакции рядом, то большинство людей, не знакомых с фокусами химии переходных металлов, возопит: “Это ошибка! Так не бывает!!”.
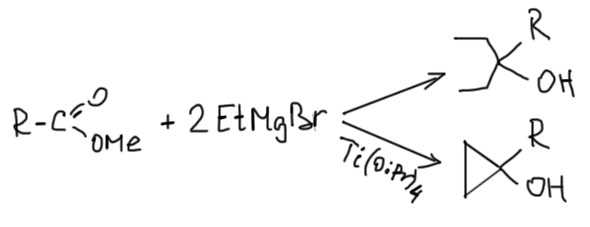
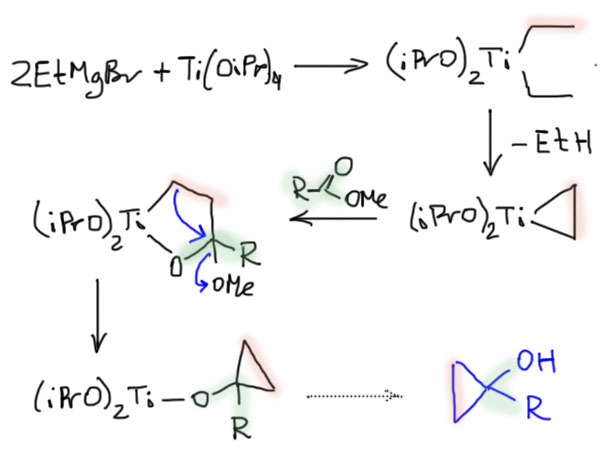
Но если представить себе, что из Гриньяра и изопропоксида титана сначала получается титанациклопропан, то дальше все происходит совершенно очевидным образом – каждая из связей Ti-C в этом интермедиате работает как карбанион точно так же, как это делают этилы в реактиве Гриньяра. Целиком каталитический цикл писать не будем, в нем много деталей, которые не до конца выяснены и нам не очень нужны.
Реакция Кулинковича фактически является каталитической по титану, но количество каталитических циклов (TON) невелико – обычно от 2 до 5. Это можно было бы считать почти стехиометрической реакцией и начать сокрушаться по этому поводу, но не забудем, что титан это не палладий и не родий, и даже не медь – это очень распространенный и весьма дешевый элемент, к тому же почти не имеющий проблем с токсичностью производных. Да и производное используется очень простое, без дорогих и сложных лигандов, простой, как это называлось в старой химии, алкоголят титана. Сейчас мы привыкли на все смотреть с точки зрения координационной химии, потому называем это как комплекс титана(4+).
В реакции Кулинковича почти всегда используется этилмагнийбромид, а следовательно образуются циклопропанолы с двумя незамещенными атомами, но зато эфиры можно брать самые разные, в том числе с стереогенными атомами углерода даже рядом с карбоксилом в енолизуемой позиции, и рацемизация не происходит. Вот, например, как можно собрать циклопропанол на защищенном пролине.
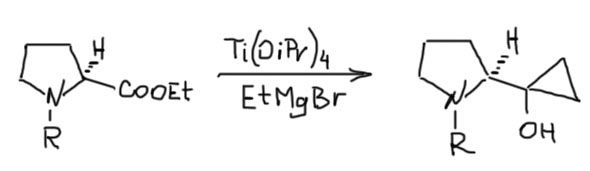
Позднее условия реакции Кулинковича были не только усовершенствованы, но и использованы в новых синтезах, например, циклопропиламинов, описанному немецким иследователем Армином де Мейере, в которых использован амид вместо сложного эфира (A. de Meijere et al., Chem. Eur. J., 2002, 8, 3789).
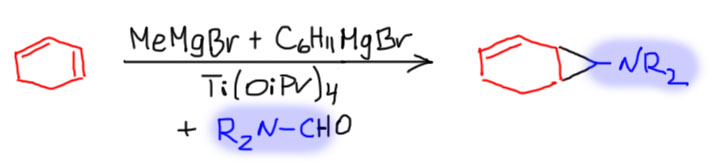
Oграничение на использование этилмагнийбромида можно легко преодолеть, потому что титанациклопропан все же ведет себя не столько как циклопропан, сколько как комплекс титана с олефином – поэтому олефин можно заменить прямо в координационной сфере. Сначала берется какой-то простой алкен, а потом ему подсовывают другой олефин, и он замещает первый олефин из координационной сферы. Для экономии еще и используют метильный гриньяр для экономии более сложного остатка, потому что один из алкилов теряется при образовании титанациклопропана. Этот прием используется в большом количестве синтезов, таким образом в реакцию Кулинковича фактически вводится олефин вместо гриньяра.
В синтезе де Мезьера-Кулинковича вместо сложного эфира используют формамид, получая циклопропиламины, уже с большим разнообразием циклопропановых заместителей из разных олефинов и даже диенов, например:
Возможности реакции Кулинковича весьма значительны и продолжают исследоваться и раскрываться.
Металлациклопропаны у поздних переходных металлов.
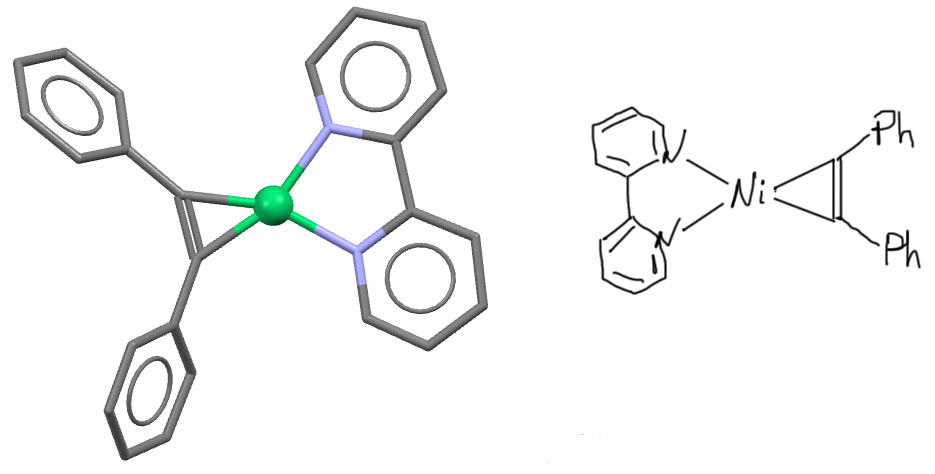
У поздних переходных металлов тоже бывают комплексы с преобладанием back-donation. Вот, например, комплекс никеля с дифенилацетиленом (J.J.Eisch et al, Eur. J. Inorg. Chem. 2001, 77-88), формально нульвалентного, типа NiL3. Но такие комплексы металлов 10 группы должны быть неплоскими, напоминать тетраэдр (здесь без одной вершины, то есть пирамидку). А этот комплекс плоский, как у d8 комплексов Ni(2+), ну и ацетилен сам не свой, выгнулся почти точно так же, как в комплексах титана и циркония. Такие комплексы никеля играют большую роль в никель-катализируемых реакциях циклоолигомеризации ацетиленов в бензол и циклооктатетраен.