Нуклеометаллирование
DC
Это задание – неудачная реакция. Задумывалось нуклеометаллирование для построения двух гетероциклов циклов в эндо-диг циклизации. Не получилось. И говорить вроде не о чем – и тон и тоф равны нулю. Но поскольку этот эксперимент использовался только как проверка направления циклизации, а в работе есть множество примеров удачных циклизаций, имеет смысл разобрать, что же там случилось, почему именно этот эксперимент ничего не дал, и какие эксперименты были удачнее.
Этот конкретный эксперимент был задуман для того, чтобы выяснить, происходит ли циклизация с участием амино-группы, присоединённой к кольцу пиразина, потому что в первоначальном замысле была такая реакция:
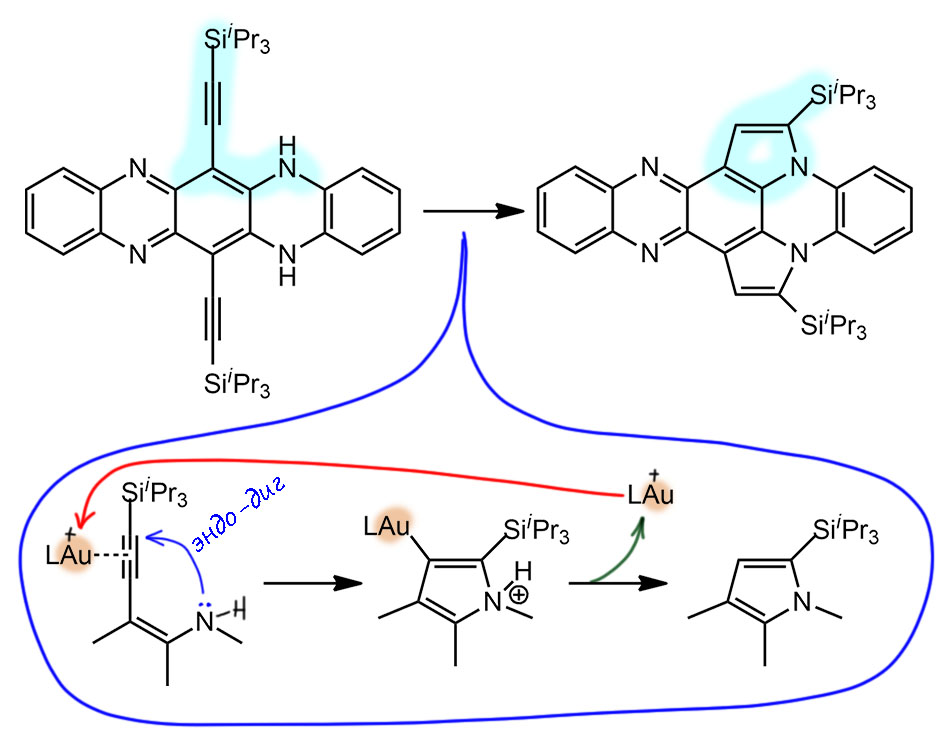
Здесь всё очевидно – обычное внутримолекулярное нуклеометаллирование. Электрофильный комплекс золота(1+) координируется по тройной связи, электрофильно активирует её для внутримолекулярной атаки нуклеофильного азота; образующийся комплекс золота подвергается протолизу – вуаля, продукт (с вторым кольцом то же самое). Но получился другой продукт, похожий, но другой (там еще есть продукты, образовавшиеся в результате перегруппировки силильной группы, но это нам сейчас совсем неинтересно, да и продукты те побочные).
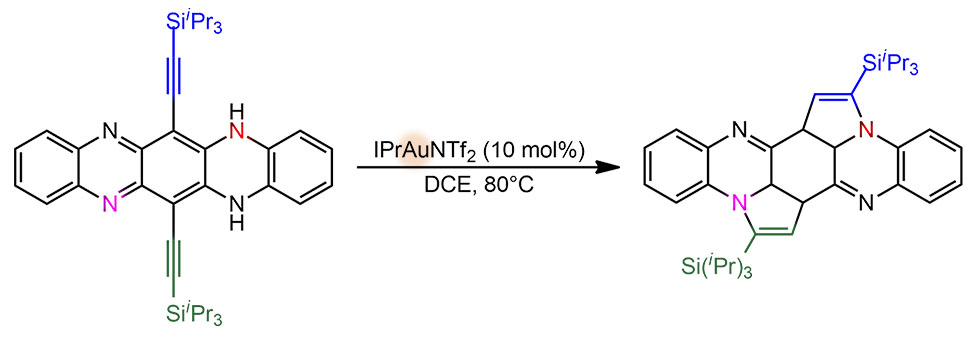
Тут же встал вопрос – а в какую сторону идёт реакция, в сторону пиридинового азота (так называется любой азот в ароматическом гетероцикле, участвующий в ароматическом сопряжении одним электроном двойной связи) или в сторону аминного азота. И как раз для этого и сделали ту реакцию, которая стала заданием DC – и убедились, что реакция не пошла.

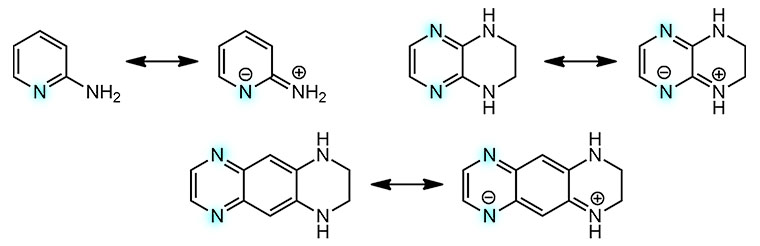
Вообще-то, чтобы понять, что эта реакция не пойдёт и куда пойдет циклизация в первом субстрате, не нужно делать опытов, а нужно просто поучить химию гетероциклов на 3-м курсе. Мы ведь отлично знаем, что у 2- и 4-аминопиридинов, аминогруппа сопряжена с кольцом, кольцо – акцептор, амин – донор; поэтому амин становится практически ненуклеофильным, а азот кольца наоборот сильно повышает нуклеофильность. Во всех таких системах именно азоты пиридинового типа являются нуклеофильными центрами, они протонируются, алкилируются, связываются с кислотами Льюиса и т.п. И то же самое будет в любых аналогах, и в том случае, если между амином и гетероциклом есть еще кольцо, то сопряжение сохраняется и эффект будет наблюдаться. На граничных структурах ниже показана делокализация только на один азот, на второй, где есть, нарисуйте сами. Поэтому ожидать, что нуклеометаллирование пойдёт в сторону амина даже довольно странно, и последняя реакция просто обречена на неудачу. Но ладно, проверили и хорошо. Золота жалко.
Поэтому циклизация субстрата, с которого мы начали, идет е так просто, хотя и тоже довольно очевидно. Первая циклизация идет на пиридиновый азот, после происходит самая обычная таутомеризация, очень похожая на кето-енольную, только с азотами. И тогда замыкается второй цикл, уже в другую сторону.
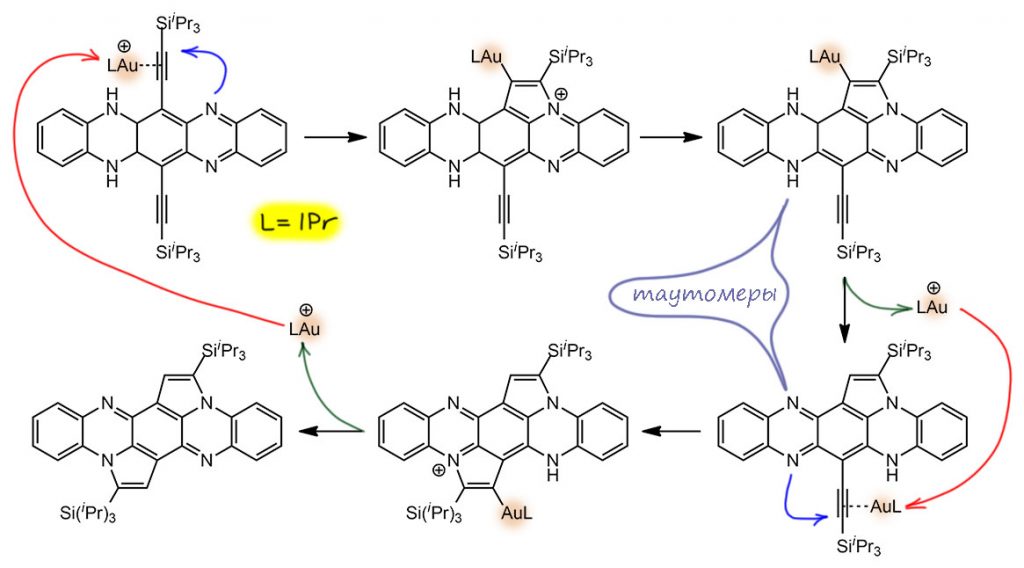
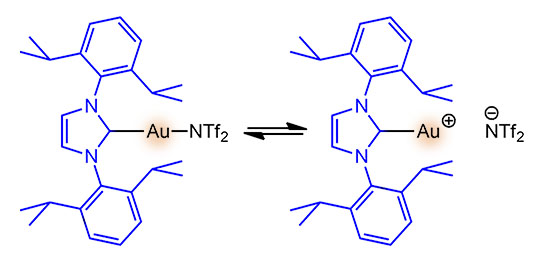
Два последовательных нуклеометаллирования, фактически это тандемный процесс. Каталитически активный комплекс золота с стандартным NHC-лигандом IPr возникает в реакционной смеси при спонтанной ионизации комплекса с бис-трифлиламидным лигандом, легко уходящим в виде аниона.
Борилирование
DD
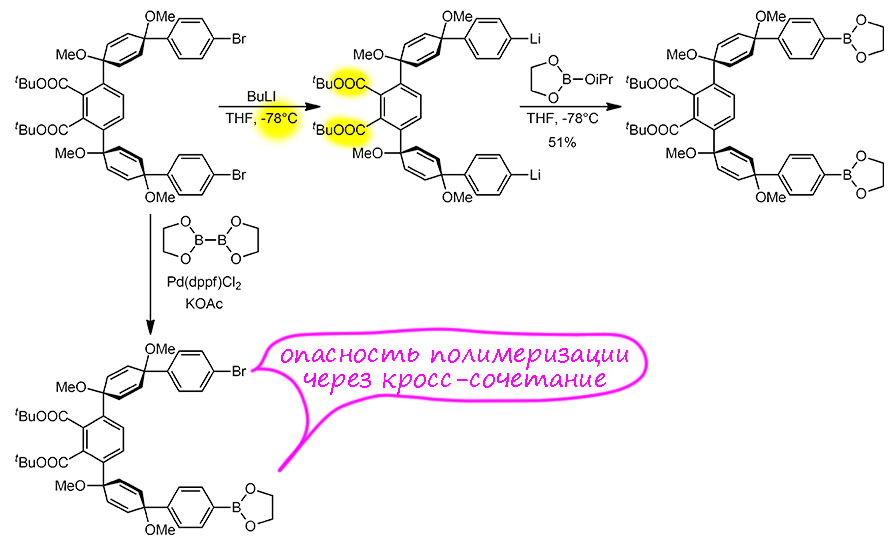
Получение боронового эфира из бромпроизводного. Такие превращения обычно делаются борилированием по Мияуре. Это очень надёжный метод, использованный и использующийся в сотнях и тысячах синтезов. Но в статье крупного немецкого химика Херманна Вегнера, очень опытного в сложном синтезе, который он использует для построения сложных функциональных материалов, этот метод не использовали, и пошли старым способом, который был основным до появления метода Мияуры в конце прошлого века – реакцией активной металлоорганики с эфирами борной кислоты. Почему такой странный выбор? Случайность исключена – в лаборатории Вегнера очень активно используют методы катализа переходными металлами, можно даже сказать, что критически зависят от этих методов, и данная работа не исключение – ключевые стадии сделаны или кросс-сочетанием или родий-катализируемой тримеризацией ацетиленов, которую мы до сих пор не разбирали.
Посмотрев еще раз на исходное, мы начинаем догадываться, в чем дело. Реакция Мияуры довольно медленная, а в молекуле два брома, очень далеких друг от друга и совершенно независимых. И хотя мы, разбирая Мияуру, всячески настаивали на том, что в условиях этой реакции не происходит кросс-сочетание Судзуки-Мияуры, прежде всего потому что используется немного другое основание, но это нельзя считать совершенно невозможным. В данном случае это привело бы к олиго- или даже полимеризации. А поскольку эта стадия уже довольно далеко от начала, этим решили не рисковать. Произвели литирование обычным способом обмена литий-галоген при низкой температуре и это позволяет не бояться проблем с сложноэфирными группами – при низкой температуре они не реагируют с литийорганикой; а для надёжности берут трет-бутиловый эфир, еще менее реакционноспособный. Всё получается, обсуждать нам тут нечего, поскольку реакция некаталитическая. Я включил ее для того, чтобы мы убедились, что хороший синтетик не зацикливается на методах, и выбирает путь синтеза с умом, не брезгуя старыми проверенными методами.
Теббе
DT
Пример метиленирования по Теббе в синтезе сложного и потенциально цитотоксичного метаболита очередного морского организма. Только это не губка, как мы уже привыкли, а динофлагеллят – жгутиковая одноклеточная водоросль, один из основных организмов морского планктона. Несколько лет назад был большой скандал с массовым отравлением людей в одном заливе на Камчатке или где-то рядом – естественно стали искать какой-то источник человеческого загрязнения моря, могильник ракетного топлива, заначку зарина на черный день или что-то типа этого. Все озабоченные люди (это хорошо, когда люди озабочены, хотя иногда это и приводит к комическим ситуациям) были страшно разгневаны и разочарованы, кгда экологи, изучив обстановку, заявили, что дело в внезапной вспышке численности морского планктона, так называемом “красном приливе”. Ну, все поругались-поругались, да и успокоились. Никто не мог понять, как вспышка численности какого-то живого существа могла вызвать отравление. Но дело очень ясное, и похоже, что объяснение верное – это было дело рук, то есть жгутиков водорослей-динофлагеллят. Мы привыкли, что сложная защита с помощью всяких сложных веществ, токсинов с головокружительно сложной структурой – дело метаболизма хотя бы многоклеточных существ, хотя бы губок и грибов, хотя и у тех и у других многоклеточность немного не того уровня, который есть у настоящих высокоорганизванных существ. Но, как мы неоднократно указывали, губки и грибы сидят себе на месте, делать им нечего, жизнь у них скучная, вот они и занимаются органическим синтезом на таком уровне, что в наше время сотни топовых синтетиков, в том числе нобелевских лауреатов, тяжело пытаются воспроизвести результаты синтетических исследований грибов и губок. Но хорошо, грибы и губки это хотя бы что-то осязаемое (осязаемость грибов – это заблуждение, не все грибы мухоморы и подосиновики). А тут мы имеем дело с продукцией одноклеточной водоросли, и молекула, скажем прямо, довольно красивая, есть чем заняться. Как же удалось такому маленькому существу замутить такой сложный синтез? Ведь для этого нужна куча всяких ферментов, а значит и генов. У одноклеточных, наверное, не может быть столько. Вот это заблуждение. Вообще все эти странные и вроде бы примитивные существа – это такие сохранившиеся обрывки брошенных направлений эволюции, не совсем удачные эксперименты по построению эукариотной клетки и через нее настоящих многоклеточных. Динофлагелляты – одни из самых странных реликтов этой далекой эпохи проб и ошибок. У этих одноклеточных совершенно невообразимо огромный геном, на многие порядки превосходящий по размеру не только геном человека, да даже и некоторых растений – в некоторых семействах царства растений колоссальные по размеру геномы. Зачем этим одноклеточным столько? Да низачем, так получилось, какая-то доисторическая клетка так увлеклась симбиозом, что нахватала множество бактерий, соединила все это в непонятное количество хромосом и запихала в свое ядро – так что если когда-нибудь вам не хватит идиомы “как сельди в бочке” для описания состояния московского метро в час-пик, можете смело говорить “как ДНК в ядре динофлагеллята” – по сравнению с этим сельди в бочке можно сказать наслаждаются свободой и обилием свободного места. Вот эта невообразимая каша, подавляющая часть которой это безусловно неработающий мусор (а может это зашифрованное послание богов о днях создания Вселенной?), вполне этих существ устраивает, они заняли свою немудреную нишу, плавают в соленой воде и ни о чем особенно не парятся. Но одна вещь в этой каше ДНК оказалась работающей – и с помощью этих генов удается делать вещества, которые помогают динофлагеллятам выбирать, когда позволено их жрать, а когда нет – иногда они начинают вырабатывать очень сложные токсины, и всяк, кто их отведает, как минимум мается животом и зарекается плавать в воде с красным отливом. Зачем это – да чёрт знает. Когда нам рассказывают сказки про то, что Эволюция созадала совершенные существа, Царство Природы, где нет ничего лишнего и все прекрасно, вспомните про динофлагеллят, которые непонятно зачем иногда начинают травить всех подряд, но для этого должны в каждом акте развмножения, то есть банального деления клетки, тщательно копировать ДНК размером с совокупный геном всех служащих Министерства иностранных дел, или иного крупного ведомства на ваш выбор (мы здесь, конечно, немного врём, потому что служащие не одноклеточные, хотя иногда так и может показаться, и у каждого очень много клеток, но как метафора – годится). Какая-то бессмысленная работа скажете вы (не про министерство, а про динофлагеллят) – как могла Эволюция так схалтурить, какое расточительство – ведь нужно сделать бесчисленное количество нуклеотидов и всяких вспомогательных веществ, для этого нужно колоссальное количество энергии и элементов. Ну да, вот так, приходится иногда пожалеть, что творением всё же не занялись настоящие боги, у них бы наверняка такая ерунда не вышла бы, хотя бы потому что боги, по описаниям всех священных книг всех цивилизаций – существа довольно ленивые, и лишней работы не любящие, и так и норовящие или опочить от трудов своих, или усесться под фикус и отъехать надолго в нирвану (это был не бог, но типа того).
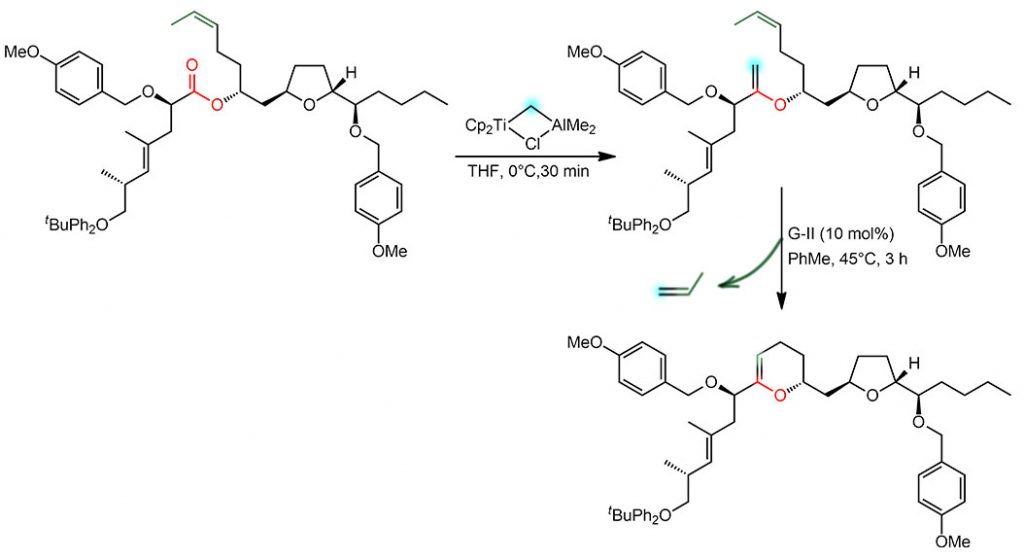
Итак, в синтезе одного из токсичных метаболитов одного из динофлагеллят потребовалось замкнуть шестичленный цикл, и для этого, понятное дело, есть метатезис, осталось сделать две двойные связи. Одну как-то приделали, а вторую перед самым метатезисом ввели реакцией метиленирования. Это очень часто встречающаяся работа – сделать двойную связь наружу от цикла или цепи, и для этого и существует Виттиг, которому недаром когда-то дали нобелевку – реакция эта не стареет. Но, у нее есть одна проблема – карбонильная группа сложных эфиров или амидов не годится. И для этого и есть реакция Теббе или Петасиса – металло-Виттиг. Здесь взяли Теббе, задачу диссоциации реагента Теббе с образованием нуклеофильного карбена Шрока выполняет ТГФ, оттаскивающий алюминийорганику в сторону. Реакция некаталитическая, поэтому TON/TOF здесь неуместны. Продукт реакции без выделения, точнее очистки, потому что смесь все же разделывают по всем правилам, но экстракт просто упаривают и пускают в метатезис с граббсом-вторым. Здесь довольно редкий случай, что вторым продуктом метатезиса является не этилен, а пропилен, но это тоже штука летучая и самопроизвольно удаляется. В остальном всё обычно.
Кулинкович
DW
В молекуле два циклопропановых кольца, одно из них строится самым простым, первоначальным вариантом реакции Кулинковича, впрочем, с некоторыми странными приключениями. В статье к этому снаряду подходят дважды. То, что дано в задании – реакция в присутствии почти стехиометрического количества изопропилата титана, 75 моль%. Вообще, трудно не задать вопрос, почему может прийти в голову такая загрузка. Это уже не катализ в полном смысле этого слова, хотя даже загрузка в 99 моль% формально считается каталитический (если конечно выход будет больше 99%), но в Кулинковиче такое встречается довольно часто. Можем это попробовать объяснить тем, что мы не знаем, с какой эффективностью исходный титановый алкоголят превращается в титанациклопропан – очень вероятно, что это не так быстро и не так количественно. Но мы не можем обсуждать то, что не знаем. 75% так 75%. Проблема в том, что кроме Кулинковича в реакции произошло и восстановление имина в амин. Для целей синтеза это несущественная проблема, фактически замена одной защитной группы на другую, не менее удобную, но нам приходится подумать, а как произошло это восстановление и связано ли оно с Кулинковичем. Но если просто прочитать опубликованную методику, в глаза бромается странное – зачем-то взято 3 эквивалента гриньяра, при том, что на Кулинковича нужно только два. Напомню, что в Кулинковиче гриньяр является стехиометрическим реагентом, и соотношение по отношению к исходному эфиру 1:2 – вот стехиометрическое уравнение, мы договорились, что в каталитических процессах очень важно не забывать писать стехиометрические уравнения, чтобы понимать, что в реакции участвует как реагент, и что – как катализатор. И мы не должны потерять ни одного атома водорода или кислорода, ни противоионов.
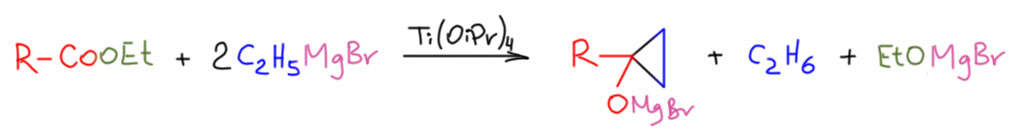
Стехиометрия 2:1 – но авторы добвляют третий эквиваленит гриньяра, и никак это не объясняют и даже, кажется вообще не обращают на это внимание, а ведь этильный гриньяр, как мы отлично знаем, может быть гидридным восстановителем карбонила, а значит и имина. Вот, видимо, и разгадка. И действительно, в эксперименте с меньшим количеством титанового комплекса (25 моль%) авторы берут расчетное количество гриньяра – два эквивалента, и не имеют никакого восстановления. Почему-то они посчитали, что это связано с количеством титана, но мы не знаем простых механизмов восстановления (гидрирования) алкильными комплексами титана, хотя может быть и еще одна гипотеза – изопропоксидный лиганд и механизм, подобный восстановлению по Меервейну-Понндорфу-Верлею – алюминий и титан очень похожи в такоих реакциях. Довольно странно в серьёзных статьях видеть такие необъяснимые косяки.
В реакции с 75 моль% титана выход 42%, то есть тут и на один цикл мы не наскребаем – некаталитическая ракция с скромным выходом. Про тихоокеанский флот в этом случае и говорить нечего. В реакции с 25 моль % титана мы видим уже полноценный катализ и два цикла за 2 часа, значит TOF – один цикл в час. Учитывая практически одинаковые выходы и одинаковые условия в этих двух реакциях, мы понимаем, что и в первой было то же, а лишний титан просто валял дурака, либо вообще ничего не делая, либо помогая восстанавливать имин.
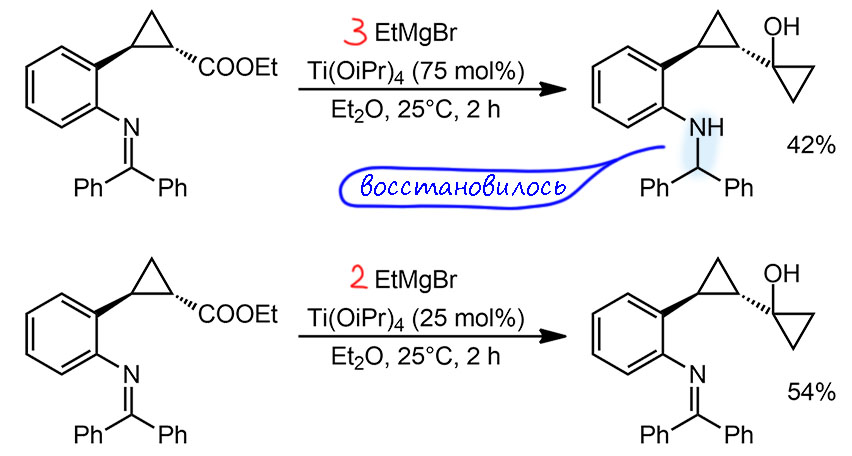
А что тут со стереоселективностью? Клинышки и зебры торчат – но в интересующем нас кольце нет никакой стереоизомерии, нет стереогенного центра, и говорить не о чем.
А вот в другом кольце стереоизомерия, а следовательно и стереоселективность есть. Но это кольцо получено циклопропанированием по Нисияме с помощью рутениевого карбеноида на пинцерном комплексе рутения с лигандом pyBOX, причем катализатор получают in situ. Лиганд этот дает и диастерео- и энантиоселективность, но последняя вообще не интересует авторов работы и они рисуют конфигурацию по образцу из предыдущих статей.
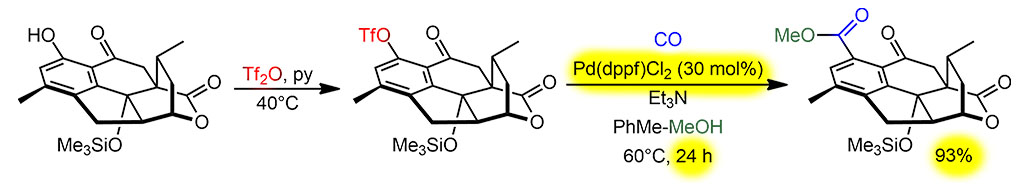
Алкоксикарбонилирование
DG
Очень хороший пример алкоксикарбонилирования, завершающего долгий синтез метаболита хвойного растения цефалотаксуса (тисса головчатого), очень красивого. Можете сходить подивиться этой “ёлке” с широченными плоскими иголками, особенно роскошной весной, когда отрастает новый прирост и дерево одевается мягкой ювенильной хвоей салатово-зеленого цвета, в ботанический сад МГУ на Воробьёвых горах, она там растет на довольно странном месте рядом с какой-то помойкой напротив романтического пруда с лягушками (2023 год: уже нельзя, оно куда-то делось, и вообще, кажется, это было что-то другое). Растения семейства тиссовые, к которым и принаждежит эта “ёлка”, вообще выделяются из хвойных ядовитостью и из них навыделяли кучу всяких соединений с хорошими перспективами применения в тяжёлой медицине. Поэтому их и продолжают изучать, и ищут эффективные методы синтеза. Этот синтез одного из таких метаболитов, цефанолида, очень остроумен и начинает из очень простых исходных с один присест сшитых двумя последовательными судзуками, мы как-нибудь отдельно разберём этот изящный ход, и сразу завязанных в полициклическую структуру одной внутримолекулярной реакцией Дильса-Альдера, в которой одновременно и возникает диенофил, и происходит собственно катализ самого циклоприсоединения мощным силилирующим агентом триметилсилилтрифлатом, который не только превращает кетон в силиловый эфир енола, диенофил, но и активирует диен координацией силильного катиона по кислороду, увеличивающей акцепторность диена – поэтому здесь мы видим реакцию Дильса-Альдера с обращёнными электронными требованиями: диен акцептор, диенофил донор.
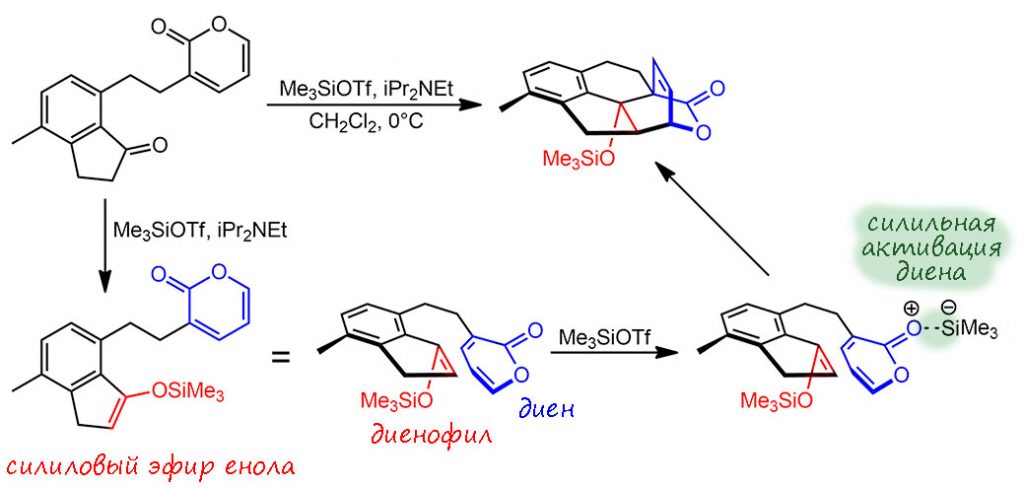
Так красиво, крупными неожиданными ходами работают крупные синтетики, хотя мы и понимаем, что сложному синтезу уже более полувека и многие такие ходы наработаны, как дебютные розыгрыши в шахматных партиях, и новым синтетикам нужно просто уметь пользоваться сокровищницей уже разыгранных партий. Эту работу сделал весьма амбициозный профессор Ричмонд Сарпонг, африканец из Ганы, ученик выдающегося химика Мартина Земмельхака, работающий в Калифорнийском университете в Беркли в основном в синтезе природных соединений. Синтез в этой статье получился настолько интересен, что стоит, пожалуй, посмотреть, что он там еще насинтезировал.
Итак, он очень быстро получил полициклический скелет, потом аккуратно ввел туда недостающую функциональность, активно используя, в частности, современные каталитические методы селективного окисления с участием комплексов переходных металлов (скоро я включу эту химию в наш курс, она уже давно просится, но пока зреет, и я не такой передовой и расторопный как африканский профессор в Беркли). И в самом конце провел метоксикарбонилирование вполне классическим способом, по Хеку, только использовав комплекс палладия с dppf, но это в карбонилировании не редкость, особенно когда субстратом является трифлат, потому что трифлатный анион не занимает место в координационной сфере, оставляя возмодность работать с бидентатным фосфином в реакциях типа Хека и карбонилирования, требующих больше мест в координационной сфере металла. Поскольку это последняя стадия длинного синтеза, вещества уже очень мало, всего несколько миллиграмм, поэтому никто не гонится за TON, а берут предкатализатора побольше, и это все равно мизерное количество, итого всего 3 цикла. И время не оптимизируют, крутили милипусенький пузырёк на блоке с иголочкой от камеры с CO, всё предельно просто, поэтому TOF всего один цикл за 8 часов (в таких случаях скорее всего реакция была намного быстрее, но анализировать лишний раз такую маленькую по загрузкам смесь смысла нет).