Первый карбен Шрока
Шрок получил первый комплекс самого простого карбена, метилена, уже в 1975 году (Schrock, R. R. J. Am. Chem. Soc. 1975, 97, 6577–6578.), когда еще неизвестен был механизм метатезиса, а интерес вызван был только структурной химией переходных металлов. Карбеновый лиганд получается депротонированием метильного лиганда в катионном комплексе тантала(5+). И в этом случае мы еще раз видим, как увеличивается кислотность какой-то группы или молекулы, когда она попадает в координационную сферу переходного металла. Надо правда отметить, что для депротонирования взяли нехилое основание, в котором многие узнают илид Виттига, только сделанный не из трифенил-, а из триметилфосфина, и это только повышает основность.
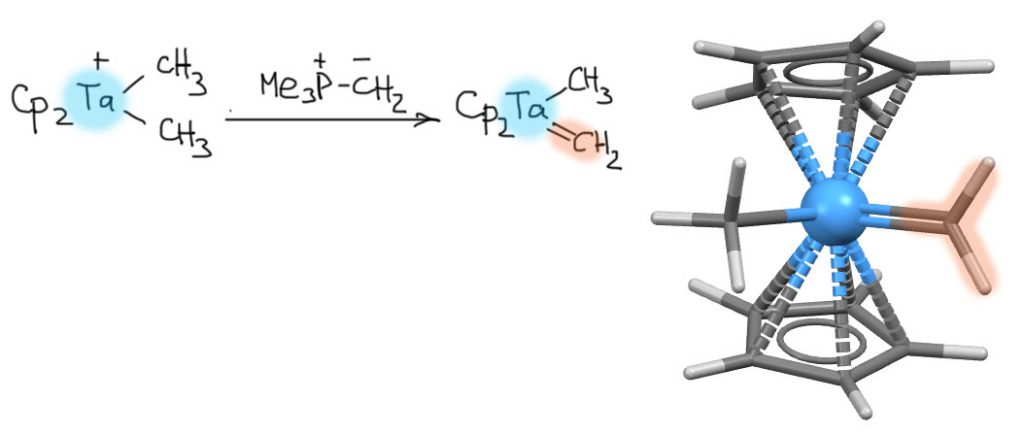
Так что же такое “карбены Шрока”?
В принципе, если мы ещё не забыли фокусы ранних переходных металлов с эффектом back donation, то поймём это без труда. Мы только в прошлой лекции обсуждали, что происходит с η2-олефином, когда его подцепил ранний переходный металл не в максимальной степени окисления. Он сдаёт лиганду два электрона через back donation, что приводит к фактическому изменению степени окисления до максимальной, конфигурации – до d0, а лиганд превращается в двойной карбанион, то есть из L превращается в два X. Мы получаем металлациклопропаны и металлациклопропены со всей их потрясающей химией.
Ну так вот и с карбеном происходит ровно то же самое. Это могло бы быть комплексом с карбеном в виде обычного L-лиганда и конфигурацией металла d2, но ранний переходный металл выполняет тот же трюк – два электрона на карбен через back donation. Карбен при этом фактически превращается в X2-лиганд, металл приобретает максимальную степень окисления и конфигурацию d0. Посмотрим на тот же первый карбен Шрока. Если бы мы продолжали считать карбен как обычно L-лигандом, у нас получился бы тантал в степени окисления +3 с конфигурацией металла d2. Почему бы и нет, собственно говоря, ничего криминального в этом нет, а счёт электронов идеальный, и вообще всё нормально. Можно было бы не париться, тем более, что, как мы уже много раз повторяли, все эти степени окисления – чисто формальная вещь, для удобства классификации, а на лиганде не написано, как он себя чуствует. Но соблазн есть. Ведь мы так видим ранние переходные металлы – считаем, что им удобнее отдать все свои электроны без остатка. Попробуем так посчитать: отправляем пару на карбен. И да – это даёт более привычную картину, тантал из 5 группы имеет степень окисления 5+ и всё остальное. А счёт электронов не изменился, но это понятно, ведь мы просто переместили электроны внутри валентной оболочки. 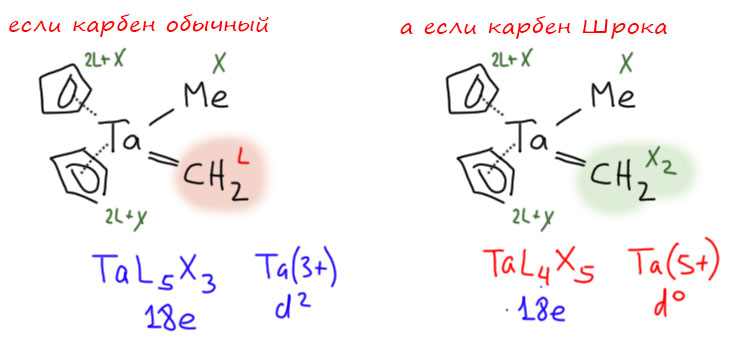
Поэтому такая операция имеет смысл. Мы в этом случае уравниваем все двухвалентные лиганды, связанные через один неметалл – оксо (=O), нитрен (=NR), карбен (=CR2) – рассматриваются как X2-лиганды одного типа. Логично, ведь для раннего переходного металла все неметаллы невероятно круты и электроны не отдают, а забирают.
Есть только одна проблема. Как это увидеть? Вот для металлациклопропанов мы отлично видели, как это отражается на структуре комплекса и лиганда – настолько ярко и недвусмысленно, что не увидеть этого невозможно. А для карбена так не получится. Конечно, там будут всякие эффекты, связанные с частичной перегибридизацией, изменятся длины связей и углы – но, во-первых, не сильно, и во-вторых, чтобы это понять, потребуются расчёты, сопоставления близких структур и прочая кропотливая работа.
Но есть второй признак – реакционная способность. В случае металлацикопропанов мы видели, что углероды, связанные с металлом, приобретали карбанионный характер, становились нуклеофилами, и охотно вступать во всякие интересные реакции типа реакции Кулинковича.
Но и здесь – то же самое. Но чтобы это увидеть, нам нужно ненадолго отвлечься от метатезиса олефинов и посмотреть, нет ли других интересных реакций у карбенов Шрока.
Олефинирование по Теббе и Петасису: карбен Шрока играет в Виттига
Напомню реакцию Виттига – реакцию карбонильного соединения с фосфорным илидом. Без деталей и с использованием фосфетанового механизма – через образование четырёхчленного интермедиата. Пренебрежём всеми дискуссиями о механизмах реакции Виттига, и возьмём этот, тем боле что он довольно популярен.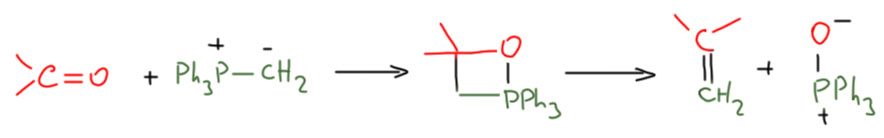
Посмотрев на этот механизм внимательно, мы поймём, что перед нами типичный метатезис – два реагента поменялись частями, да ещё и почти так же, как мы рисуем механизм Шовена для метатезиса олефинов.
Так, а теперь представим себе, что у нас есть какой-нибудь карбен Шрока, пока в самом общем виде. В карбене Шрока углерод имеет выраженный карбанионный характер, он нуклеофилен. А что если ему дать карбонильное соединение? Мы просто обязаны ожидать в этом случае, что карбен Шрока присоединится углеродом к карбонильному углероду. Очевидно, что мы можем ожидать, что металл использует освободившуюся связь, чтобы подцепить отрицательный кислород. Валентное состояние металла при этом не изменится, он просто разменяет X2-лиганд на два X-лиганда. У нас получится четырёхчленный металлацикл. Ну очень похожий на фосфетан из реакции Виттига. И, с другой стороны, на металлациклобутаны из механизма Шовена. А дальше есть очень большой шанс, что четырёхчленный цикл развалится на олефин и оксо-комплекс раннего переходного металла. Многие ранние переходные металлы любят кислород больше всего на свете и не упустят шанса обменять какой-то невнятный карбен Шрока на полноценный настояший кислород. Вот так – не правда ли, похоже на Виттига почти как две капли воды. Но и на метатезис тоже похоже. Если действительно есть такая реакция, а выглядит эта схема очень убедительно, то ее можно было бы назвать металло-Виттиг, а можно было бы назвать метатезис алкен-карбонил. 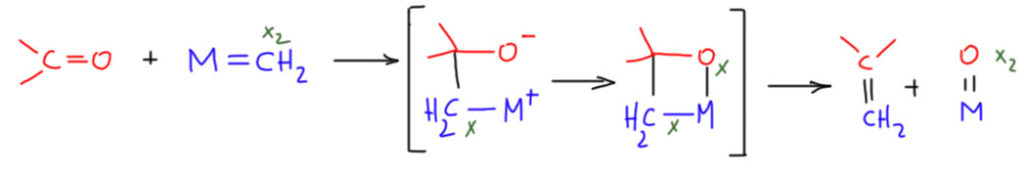
А может это фантазии? Есть ли реальные реакции, которые так идут? Есть, и с тех пор, как Фредерик Теббе, работая на компанию ДюПон, открыл первый реагент такого типа в 1974 году, ставший одним из самых знаменитых металлоорганических реагентов 20 века, их наоткрывали и внедрили в органический синтез не меньше десятка.
Реагент Теббе получается действием двух эквивалентов триметилалюминия на легкодоступный титаноцендихлорид. Первым делом происходит переметаллирование – метил переезжает с более электроположительного непереходного металла на менее электроположительный переходный. Следующая стадия тоже довольно проста. Мы уже видели нечто подобное, когда разбирали реакцию Кулинковича. Ранний переходный металл электрофильно активирует алкильный лиганд (опять мы встречаемся с общей тенденцией – металл увеличивает кислотность связанного лиганда – сколько мы уже видели примеров таких реакций!), и метил на титане становится CH-кислотой. Протон с этой кислоты снимает триметилалюминий (органические группы на непереходном металле имеют карбанионный характер, более сильный у литий и магнийорганики, но и производные алюминия тоже весьма основны). Образующийся метиленовый лиганд вторую валентность закономерно отдаёт алюминию – получается такой двухядерный комплекс с металлами двух типов. Хлорид закрепляет конфигурацию, работая как мостиковый лиганд. Образуется реагент Теббе, который можно хранить и применять по необходимости. А где же карбен Шрока? 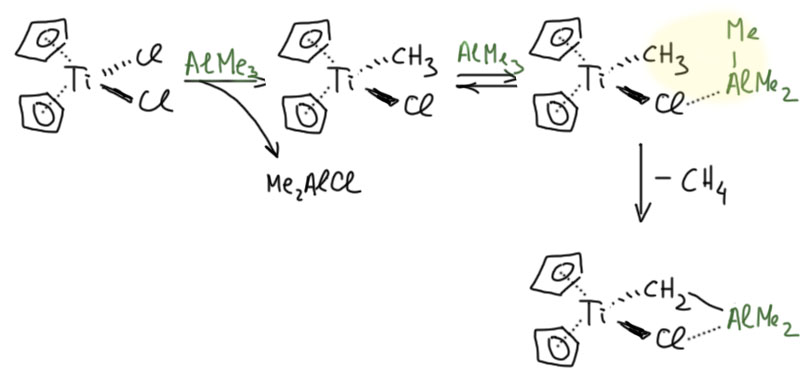
Очень просто. Этот комплекс очень легко разлагается основаниями Льюиса, например, банальным пиридином. Пиридин просто координируется по алюминию и снимает его Это делают прямо в присутствии карбонильного соединения, и образующийся титановый карбен Шрока мягко и селективно даёт вместо карбонильного кислорода метиленовую группу. 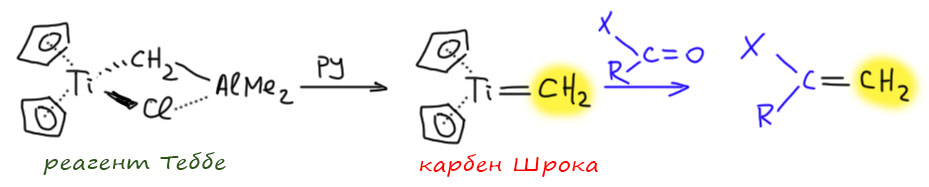
А зачем нужен такой с виду непростой реагент, если есть илид Виттига? Во-первых, в органическом синтезе лишних реагентов не бывает. Ситуаций, в которые может попасть синтетик в сложном синтезе так много, что чем больше выбор реагентов, тем больше шансов добраться до цели. У каждого реагента есть свои особенности и свой синтетический диапазон, свои ограничения и свои достоинства. Реагент Виттига – очень сильное основание и его нельзя применять, если в соединении, которое нужно превратить в олефин, есть кислые водороды. Реагент Теббе гораздо в этом смысле мягче. Кроме того, реагент Теббе даёт возможность делать то, что многие безуспешно пытаются сделать на 3 курсе с Виттигом – вместо альдегидов и кетонов использовать сложные эфиры или амида. Реагент Теббе делает это почти без проблем, то есть X в приведённой схеме может быть не только алкилом или арилом, но и и OR или NR2, что прямо даёт эфиры енолов или енамины.
Реагент Петасиса
Реагент Теббе очень популярен в сложных синтезах, но некоторые недостатки у него тоже есть. Он тащит в реакцию алюминийорганику, которая потенциально пирофорна, и требует очень аккуратной обработки смеси после реакции, а кроме того в этой части реагента довольно большая основность, и это тоже может вызвать проблемы. Усовершенствований реагента Теббе было предложено немало, но самая удачная предложена Никосом Петасисом и сотрудниками в 1990. Это ровно тот же карбен Шрока (сам Петасис уверял, что механизм действия его реагента совсем другой, но это не нашло подтверждения), но образуется он из другого исходного – из диметилтитаноцена, который легко получается в растворе из титаноцендихлорида и метиллития переметаллированием. Диметилтитаноцен даёт карбен Шрока просто при мягком нагревании в растворе. Реакция та же самая, только протон с одного метила снимает другой метил. 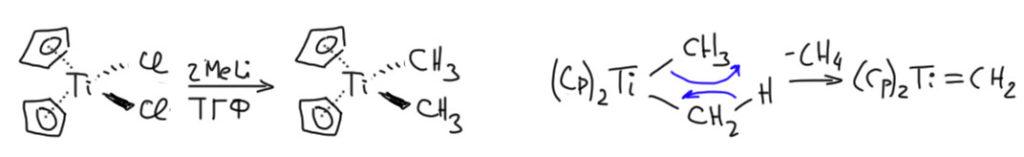
Дальше мы знаем. Вот примеры прямо из статьи Петасиса (J. Am. Chem. Sос., 1990, 112 (17) 6392)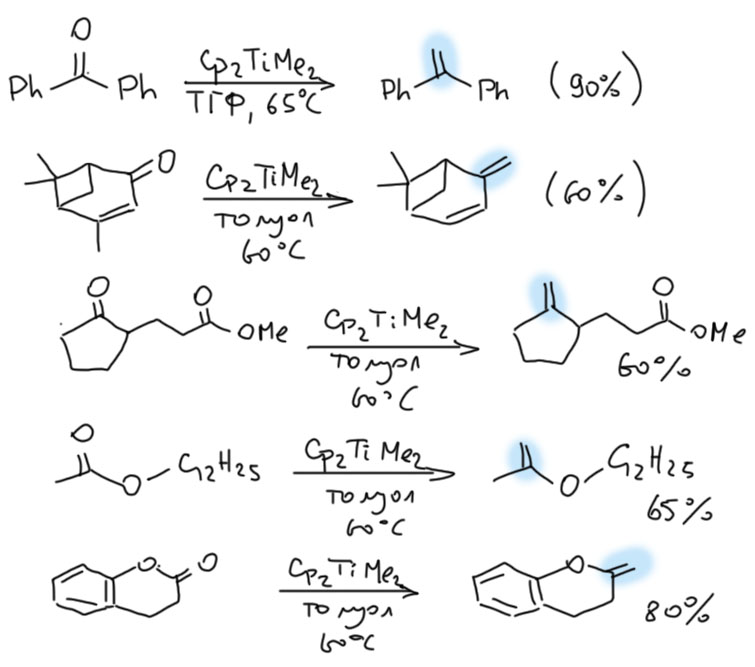
Катализатор Граббса 2-поколения
Лигандный обмен в катализаторе Граббса 1-го поколения с гетероциклическим карбеном IMes дает катализатор Граббса 2 поколения (Grubbs et al, Tetrahedron Lett. 40 (1999) 2247-2250). Активность этого катализатора приблизительно такая же, как у Граббса-I, но он более живуч, особенно при повышенной температуре. Структура показана для близкого аналога с NHC-лигандом SIMes (Wagener, Organometallics 2005, 24, 1477-1482).
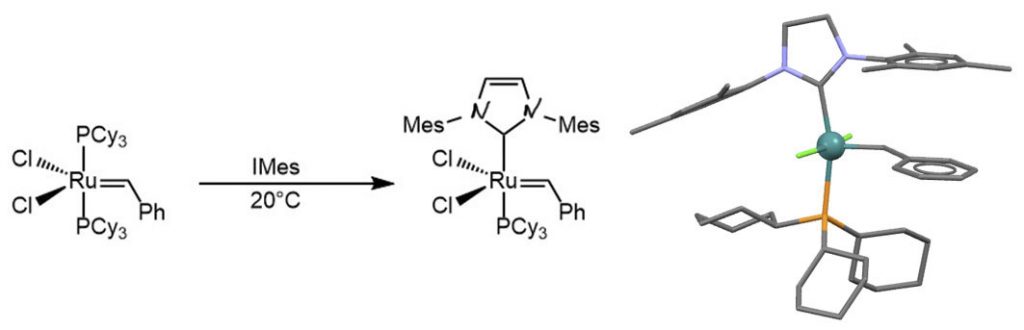
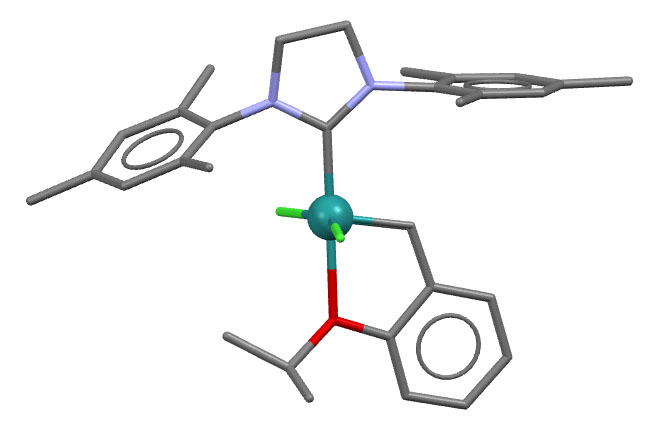
Катализатор Ховейды-Граббса 2-го поколения
Структура близкого аналога (CCDC 759916)
Пример. Циклизация в сверхкритической углекислоте
Алоиз Фюрстер с сотр. показали, что сверхкритическая углекислота – отличный растворитель для RCM (). Можно использовать самые обычные катализаторы Шрока и Граббса, выходы отличные, и ADMET почти не мешает, если правильно подобрать давление. Сверхкритическая жидкость – штука странная, ее плотность очень сильно зависит от давления, как у газа, но при этом это именно жидкость, способная растворять, а значит и сольватировать самые разные вещества. И просто изменяя давление можно достигать того же эффекта, как в обычной жидкости, когда мы изменяем концентрацию. Это даёт эффект при образовании макроциклов почти такой же как при разведении. Первый из продуктов – один из компонентов эфирного масла кипариса караханоенон. Второй – эпилахнен, защитное вещество одного мексиканского жука. Впрочем, мы видим, что ен-еновый метатезис нестереоселективен и даёт смесь цис и транс изомеров. Чтобы одолеть эту проблему именно Фюрстер придумал использовать ин-иновый метатезис.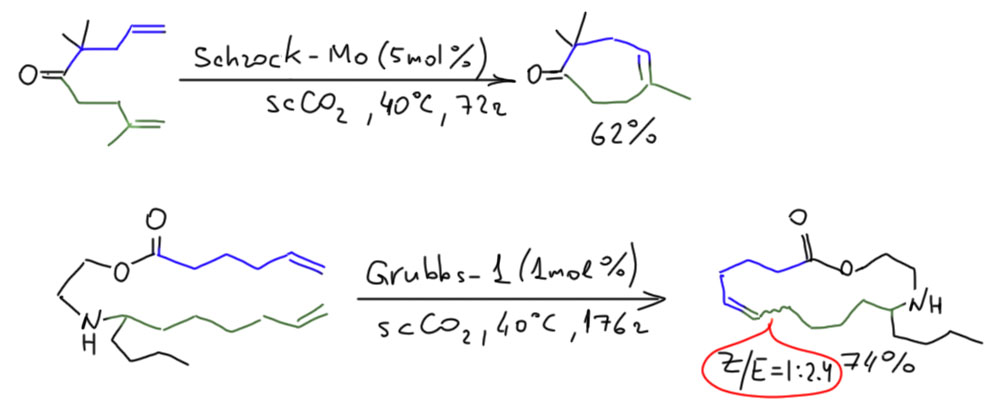
Вопрос: продукты каскадного метатезиса
Нарисовать продукты метатезиса олефинов или алкинов нетрудно, а вот с ен-иновым метатезисом это не так просто. И ещё хитрее бывает ситуация, когда ен-иновый метатезис каскадится с обычным ен-еновым.
Попробуйте нарисовать продукты метатезиса из вот таких исходных. Во всех трёх случаях продукт содержит две двойные связи, а в ходе реакции образуется этилен. 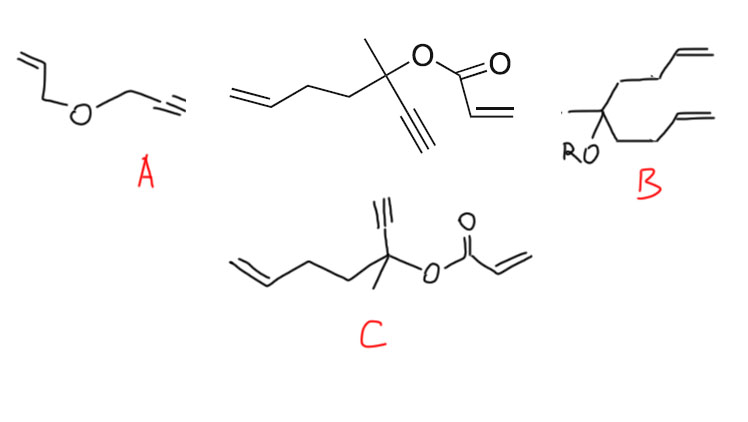
Внимание: пока не парьтесь с этим вопросом, он никак не оценивается. Ениновый метатезис пока на сайте проработан плохо, то есть просто никак, и нормально эту задачу не решить. Я вернусь к ней, когда дополню сайт и лекции более адекватным описанием енинового метатезиса.
