Четыре карбопалладирования и загадка элиминирования
Очень интересный каскад описан в работе видного каскадёра из Германии Даниэля Верца с сотрудниками. Они задумали разработать метод синтеза целого семейства кросс-сопряжённых систем с пентафульваленовым ядром, и задумали довольно авантюрный каскад, в который будут вовлечены три тройные связи, но сталий карбопалладирования должно быть четыре – в последней стадии палладий должен укусить двойную связь, образовавшуюся в первом карбопалладировании. Это виртуозный замысел, потому что каскады на бумаге выглядят очень красиво, но на деле вовсе необязательно реакционные центры окажутся сближены на любой из стадий. Сейчас ход такого процесса проще было бы сначала промоделировать расчётом, но это было 10 лет назад, (J. Wallbaum, R. Neufeld, D. Stalke, D. B. Werz, Angew. Chem. Int. Ed. 2013, 52, 13243–13246) и рачеты немаленьких молекул на хорошем уровне были еще не настолько доступны как сейчас. Приходилось рисковать. Риск оправдался, цикл сошёлся, и была получена целая серия желаемых продуктов с выходами от 39 до 91%, в очень простой и типичной для каскадной химии системе [Pd(PPh3)4] (10 моль%) – триэтиламин в толуоле при 60°C. За TON и TOF, как бычно в каскадах никто не гнался, как видим, больше 10 оборотов не планировалось, а реально было меньше, ну и TOF меньше оборота в час.
Посмотрим на базовой модели (остальные отличались заместителями и иногда встроенностью мостика в нафталиновую систему, но общий замысел был везде одинаков). Каскад, как обычно, инициируется окислительным присоединением. Первая тройная связь прямо под носом – не промажешь, да и прецедентов таких полно. Но дальше идут карбопалладирования на довольно гибкую цепь, первое – с образованием семичленного кольца, так что риск был немалый, что эта цепь не захочет быть пойманной палладиевым центром. Вообще, один из секретов того, что палладий так хорошо прошивает каскадами сложные системы, состоящие и из циклов и из цепей, состоит в том, что паллдаиевые интермедиаты вполне устойчивы и сами по себе никуда не денутся, поэтому у них много времени на то, чтобы спокойно сидеть и ловить болтающуюся верёвочку, как матрос на пирсе ловит швартовочный конец. Мы видим, что реакция очень медленная – и это неудивительно – энтропия тут везде играет на на стороне каскадёров. Так, прыгая со связи на связь и свершились четыре карбопалладировования, и последнее пришлось на первую образовавшуюся двойную связь. Как и положено вся прошли с син-стереохимией. И вот мы смотрим на последний интермедиат и понимаем, что у него проблема и вполне ожидаемая – палладий и водород оказались по разную сторону баррикады, то есть последней из образовавшихся связей, и никак не могли создать условия для завершения процесса β-гидридного элиминирования.
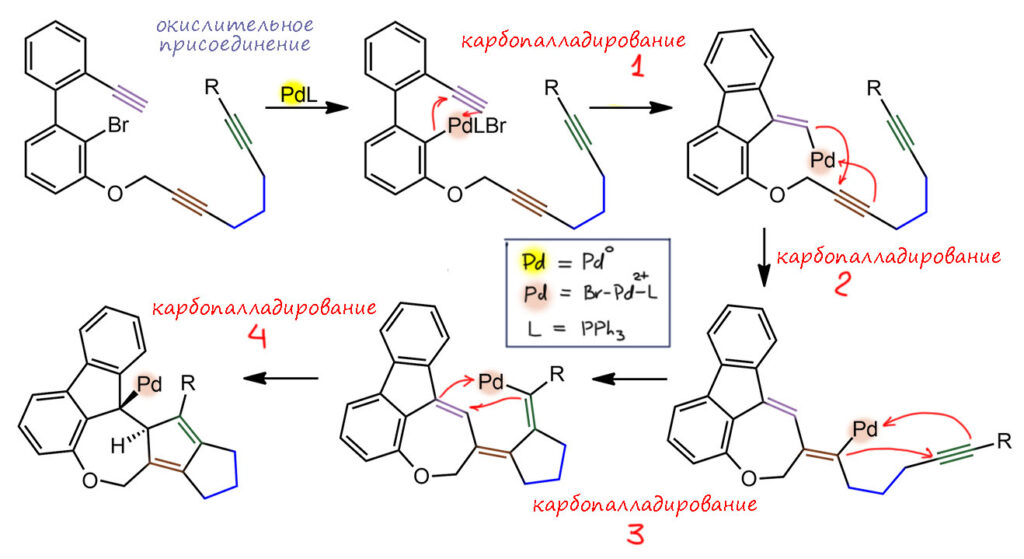
В принципе, если бы дело застопорилось на последней стадии, можно было бы просто заткнуть это место гидридом, как это часто делают, но авторам затеи нужна была двойная связь, и тогда нужно было бы ее наводить отдельно. К счастью для затейников, двойная связь навелась сама, и продукт оказался искомым пентафульваленом. Как же это получилось.
Есттественно, в ход должны пойти гипотезы, но обоснованные. Самая простая – а вдруг впервые случилось анти-β-гидридное элиминирование! Но прецедентов в химии палладия как не было, так и нет, поэтому мы не имеем право выдвигать совсем необоснованную гипотезу.
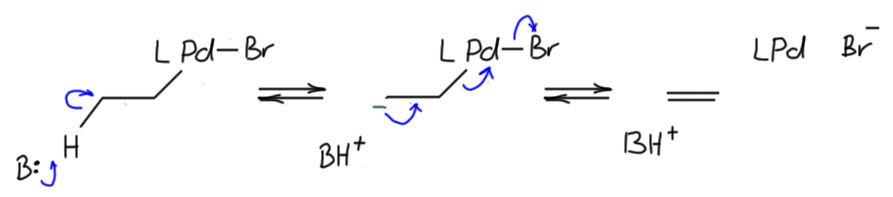
Авторы сами предложили идею – а вдруг это самое обычное E2-элиминирование, с палладием в роли уходящей группы – нуклеофуга, и в этом случае он заберет с собой пару, а значит восстановится до Pd(0), причём выбросит при этом бромид, чтобы не стать малоустойчивым анионным ат-комплексом.
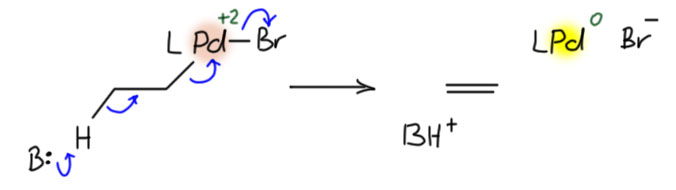
Ничего невозможного в этом нет, но если бы это было возможно, мы бы нередко видели нарушение син-гидридного элиминированя. А видим мы его так редко, что каждый раз хватаемся за голову. Вс обширная химия палладиевых каскадом стоит на этом как на гранитном основании.
Авторы тоже не хотят так подставляться, поэтому предполагают, что дело в повышенной кислотности протона, – ведь это циклопентадиеновая система. Именно это, полагают они, и облегчает элиминирование. В этом месте они делают типичную ошибку людей, не искушенных в механизмах чисто органических реакций. На самом деле, для E2-элиминирования кислотность протона большой роли не играет – ведь это согласованный механизм. Додумаем эту гипотезу за них. Фактически они говорят (но не говорят), что палладиевый комплекс представляет собой очень плохую уходящую группу, – вот в этом случае её действительно надо подталкивать повышенной кислотностью, а значит – это не E2, а E1cb-элиминирование, для которого нужно сначала обратимо образовать карбанион.
Примем на этой стадии эту гипотезу и сразу увидим то, что в упор не видят авторы – если такое депротонирование есть, то оно обратимо (не может быть по другому, если основности основаниея недостаточно для полного и количественного депротонирвоания – здесь это явно так, но об этом дальше). А раз оно обратимо, то происходит – не может не происходить – очень быстрая эпимеризация на этом углероде. Такая эпимеризация заведомо быстрее любого элиминирования, а мы ведь еще и предположили, что палладий – плохая уходящая группа. Плохая и тяжёлая, как тележка с навозом, еле ворочается, а протон в это время скачет как бешеный, такова его природа. И тогда водород будет появляться в син-положении, и немедленно сноситься палладием в самом обычном син-β-гидридном элиминировании, и никакого другого элиминирования вообще не требуется.
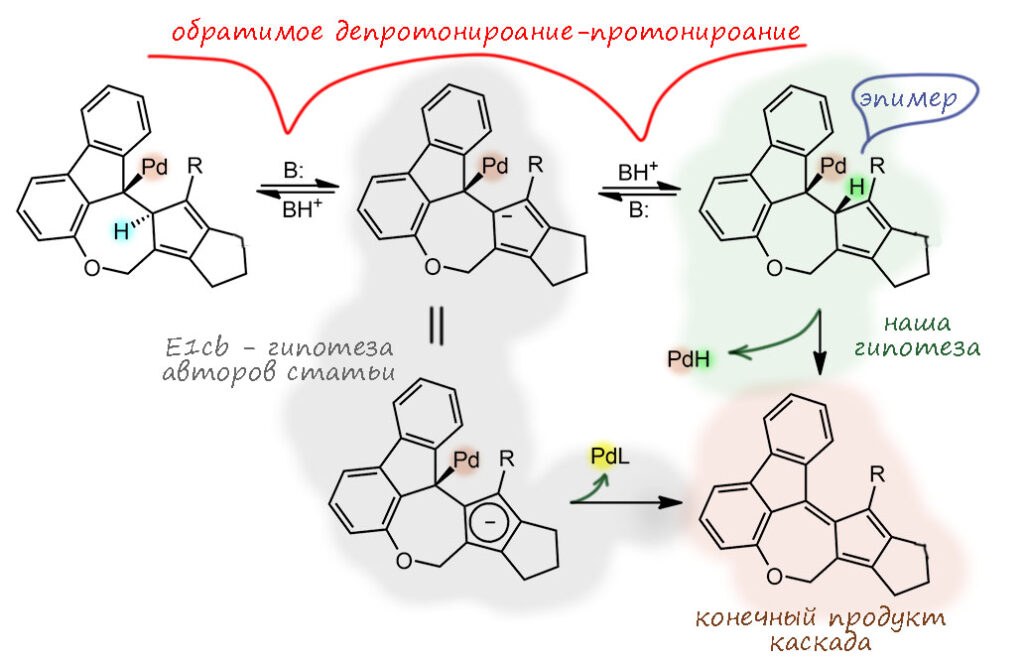
В этом месте можно было бы завершить обсуждение, но осталась ещё одна вещь – а правда триэтиламина хватило бы для депротонирования циклопентадиенильной системы. Нам не нужно ни количественное депротонирование. ни даже значительное равновесное депротонирование. Реакции с участием сопряжённых оснований CH-кислот часто идут и в случае, когда между кислотностью CH-кислоты и основностью основания зазор в несколько порядков не в пользу основания. Если реакция быстра, то она пойдёт и из совершенно мизерной концентрации депротонированной формы. Поскольку в нашей гипотезе реакцией является эпимеризация, за которой следует обычное син-β-гидридное элиминирование, а это обычно очень быстрые реакции, то и здесь вроде всё сходится. Но сомнения грызут. Всё же циклопентадиен и триэтиламин совсем в разных весовых категориях. Циклопентадиены отлично равновесно депротонируются обычной щёлочью, что и было сделано еще в начале 20-го века, когда так стали получать фульвены, но триэтиламину до щелочи далеко. И растворитель малополярный – совсем неподходящий для реакций с цчстием ионов. Ох, что-то скрипит в гипотезе депротонирования. Нет, она не совсем не проходит, мы её довольно хорошо разложили и доводов за там немало. Но можно про запас поискать что-то ещё.
И такая запасная гипотеза есть. Это тоже эпимеризация, но не CH, а палладиевого центра. Палладий там висит в бензильном положении, а для бензильных комплексов, как и для аллильных, хорошо известна эпимеризация через η3-формы комплексов – палладий как будто соскальзывает со своего положения в положение над и слегка сбоку, и из этого пложения может переползти на другую сторону. Как-то так разрешаются проблемы с завершением реакции Хека в системах типа инденов и т.п. Там тоже есть вопросы, потому что непросто представить себе это движение, и не факт, что оно легко совершится в такой, весьма жёсткой молекуле, но вариант такой есть, и сбрасывать его со счетов не стоит.
Вот как эпимеризуются бензильные комплексы палладия – несколько равновесий η1-η3-комплексов (показаны только три, но по-настоящему надо разрисовать и комплексы с другого конца системы). Когда это просто открытый бензил, всё вообще просто, птому что при переходе к η3-комплексу, ослабляется контроль конфигурации на стереогенном центре, и в обратном превращении конфигурация рандомизуется.
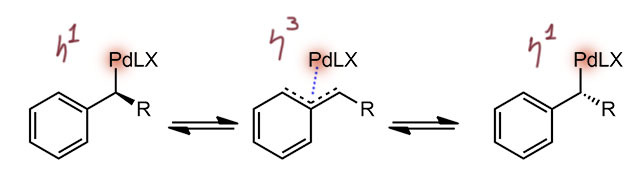
В более жесткой системе типа той, что в этой работе, это гораздо сложнее себе представить, и мы пока не будем – хорошо бы найти похожие случаи и вообще как-то это промоделировать. Тем не менее, возможность такой эпимеризации есть, и тогда уже именно палалдий переедет к водороду, что и завершится син-β-гидридным элиминированием. Как-то так:
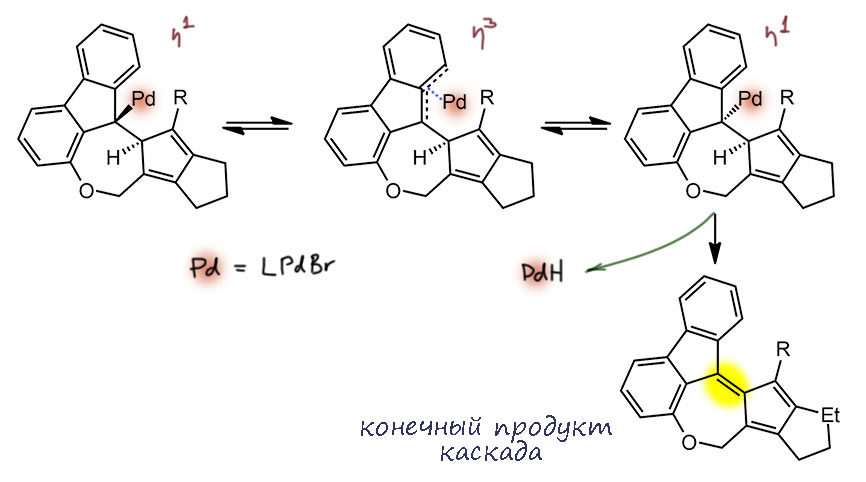
Итак, мы придумали альтернативные завершения каскада, обходящие проьлему невозможности анти-β-гидридного элиминирования. Оба завершения предполагают эпимеризацию одного из двух стереогенных центров с образованием необходимой син-конфигурации, то есть мы предполагаем, что каскад таки завершается этой стандартной стадией, и необходимости выдумывать обычные элиминирования, то ли E2, то ли E1cb с палладием в роли нуклеофуга нет. Безусловно всё это только гипотезы. Попробуем найти какие-то аналоги (минимум 20 плюсов за хорошую наводку, возможно больше, если из неё получится интересный материал).
