Реакция Дёца (бензоаннелирование по Дёцу)
Карбены Фишера, с которыми мы уже успели познакомиться, вступают и в очень нетривиальные многостадийные превращения. Одна из самых известных реакций такого типа была открыта учеником Фишера Карлом Хайнцем Дёцем (Dötz K. H., Angew. Chem. Int. Ed. Engl., 1975, 14, 644), и это одна из первых сложных реакций, запускаемых исключительно за счет возможностей комплексов переходных металлов, так, что прямых аналогов в обычной органической химии найти не получится. Реакция вызвала значительный интерес и нашла довольно широкое применение в синтезе. В принципе, это довольно типичный каскад, но поскольку реакция стехиометрическая и в конце переходный металл безвозвратно уходит в отход, каскадом её не называют. Необходимый для этой реакции карбонил хрома – штука довольно дешевая и простая в обращении, У реакции очень интересный механизм, который в принципе составлен из хорошо знакомых нам элементарных стадий, но эти стадии выглядят необычно именно потому что в них участвует карбен Фишера. Разберём эту необычную реакцию – это очень интересно и поучительно. Термин бензоаннелирование означает, что в результате реакции образуется новое бензольное кольцо, пристроенное к скелету одного из исходных.
Для реакции понадобится хромовый карбен Фишера с органическим остатком или винильного или фенильного типа. И дизамещенный или монозамещённый ацетилен. И больше ничего, реакция обычно идет просто при нагревании. В конце смесь хорошенько проветривают, и выделяют продукт обычным способом, стараясь как можно больше операций проводить на воздухе, особенно хорошо идет колоночная хроматография. Эта странная концовка нужна чтобы окислить и убрать хромтрикарбонильный остаток, потому что иначе его придется отдельно окислять. В результате реакции образуется новое кольцо с фенольной группой, составленное из трех частей – два атома углерода – из карбена. Два – из ацетилена. Углерод с фенольной группой – из CO, взятого из исходного карбонила.
Разберём механизм, максимально упростив участников. Возьмём винильный карбен, который можно получить действием виниллития на карбонил хрома. И симметричный ацетилен. Реакция начинается как обычный лигандный обмен одного карбонила на ацетилен, поcкольку исходный комплекс координационно насыщен, то по диссоциативно-ассоциативному механизму. Связь back-donation я везде подкрашу зеленым.
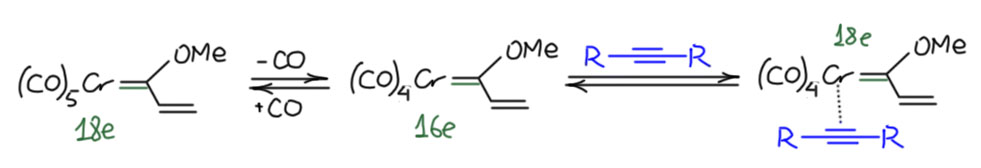
Дальше происходит совершенно обычная реакция миграционного внедрения по тройной связи. Но фокус в том, что углеродный лиганд в этом случае – карбен с электрофильным углеродом, и как только он слезет с металла и отправится в самостоятельную жизнь, выяснится, что у него вакантная орбиталь. А у хрома есть пара, та самая, что в карбеновом комплексе обслуживает back-donation. Это можно обозначить с помощью плюса на углероде и минуса на металле. Ну и мы видим, что смещение пары дает нам новый карбеновый комплекс, тройная связь полностью рассосалась в простую, а бывший карбеновый углерод заткнулся, приняв π-связь. Продукт этой стадии представляет собой новый карбеновый комплекс, что мы и отмечаем, нарисовав зелененькую вторую связь по back-donation. Более того, этот карбен даже можно тоже назвать карбеном Фишера, только винилогичным – донорный эффект метоксила в нём вполне дотягивается до карбенового центра за счёт сопряжения. Это делает стадию выгодной.
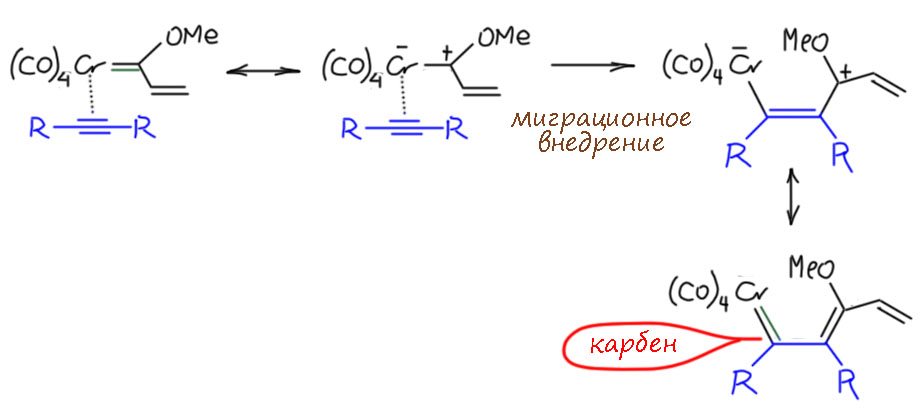
Следующая стадия тоже нам близка и понятна – это ещё одно миграционное внедрение, на этот раз с участием одного из карбонилов. Но внедряться ему приходится по связи с карбеном, поэтому и здесь есть особенности. Пока остановимся на промежуточном комплексе, который вроде ацильный, но какой-то немного необычный. Собственно необычности в нём не так много, во-первых, там на сопряженной системе делокализованный плюс, во-вторых, хром так понемногу растерял лиганды и сейчас он сильно координационно ненасыщен, свободны ддва места.
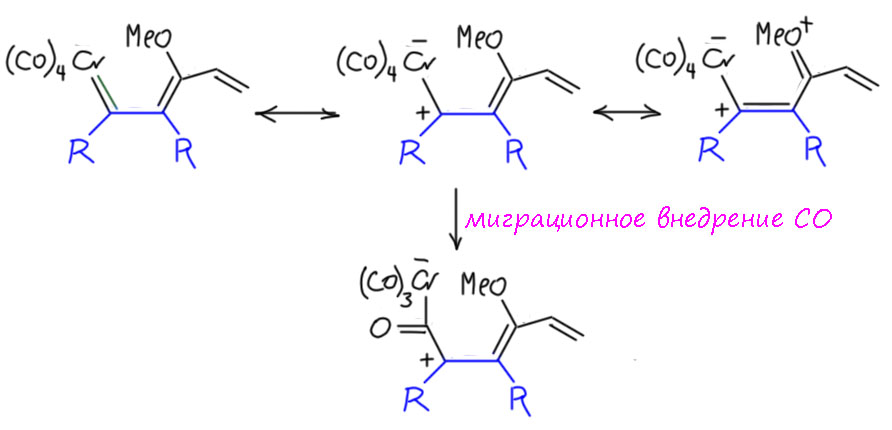
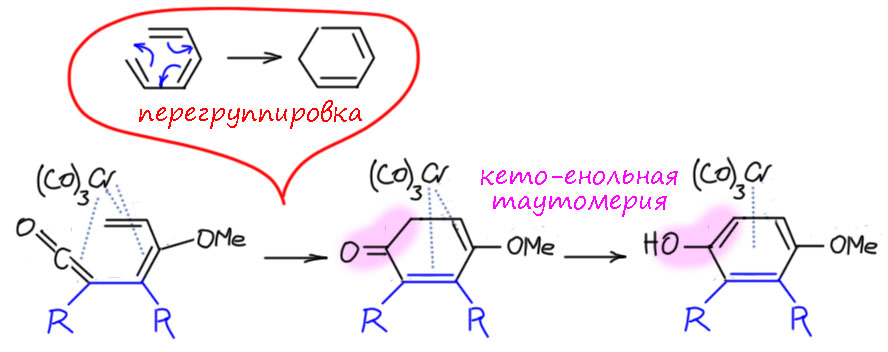
И тогда с этим интермедиатом происходит зрелищное превращение – но если подумать, то это просто лигандный обмен: трикарбонилхром слезает с ацильной группы, оставляя её формально с отрицательным зарядом – но поскольку рядом заряд положительный они рекомбинируют, образуя кетен. А хром получает аж три свободных координационных места и разом удовлетворяет их, сев на три двойные связи (понятно, что в реальности хром стадийно садится на двойные связи одну за другой, и скорее всего этот процесс начался заранее. Поскольку двойные связи сопряжены, это не трижды-дигапто, а гексагапто. И вот что мы имеем:
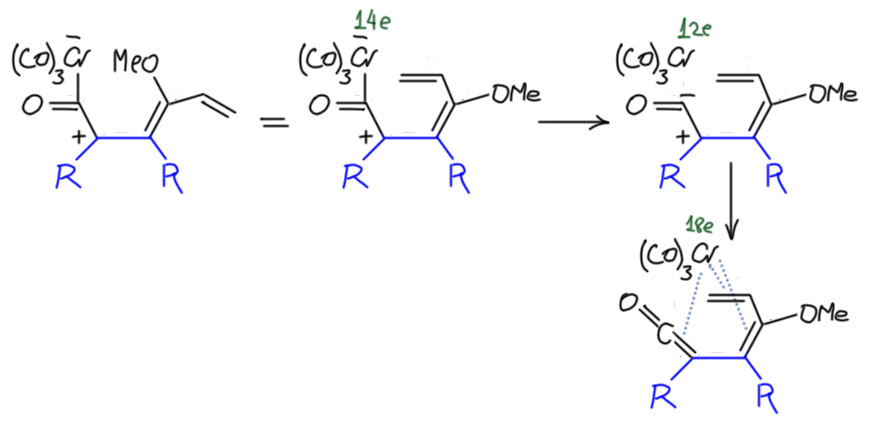
Следующий шаг – последний. И это хорошо известная в органике согласованная перегруппировка гексатриен-циклогексадиеновая, за которой следует превращение кетона в енол, и это фенол, и это бензольное кольцо, да еще и дополнительно стабилизированное комплексообразованием с трикарбонилхромом. Образовался такой фенол, а хром легко уходит при мягком окислении, часто даже просто кислородом воздуха при выделении продуктов.
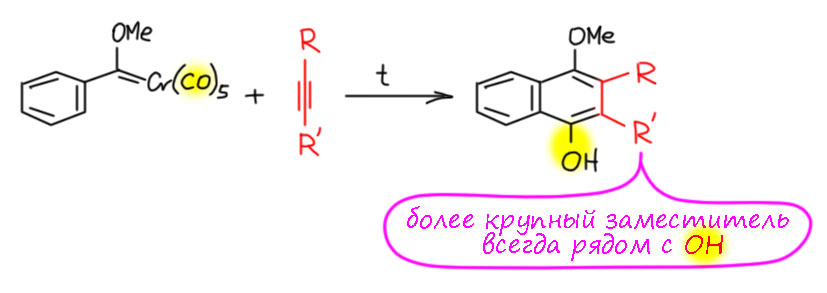
Очень часто новое кольцо пристраивают к уже существующему бензольному или гетероциклическому. Ароматическая делокализация в существующем кольце не мешает перегруппировке. Во всех известных примерах реакции Дёца ацетилен пристыковывается всегда однозначно – более крупный заместитель (если ацетилен дизамещенный) или единственный заместитель (если монозамещённый) оказывается рядом с гидроксильной группой, образовавшейся на стадии миграционного внедрения карбонила. Это очень легко понять, если не забывать, что в реакциях с переходными металлами самый главный эффект – стерический. Миграционное внедрение ацетилена осуществляется в дигапто-комплексе, который безусловно будет устроен так, что более крупный заместитель окажется дальше от реакционного центра.
Как работает реакция Дёца лучше рассмотреть на нескольких примерах, рассмотренных на вкладках.
Пример использования бензоаннелирования в синтезе природного соединенния
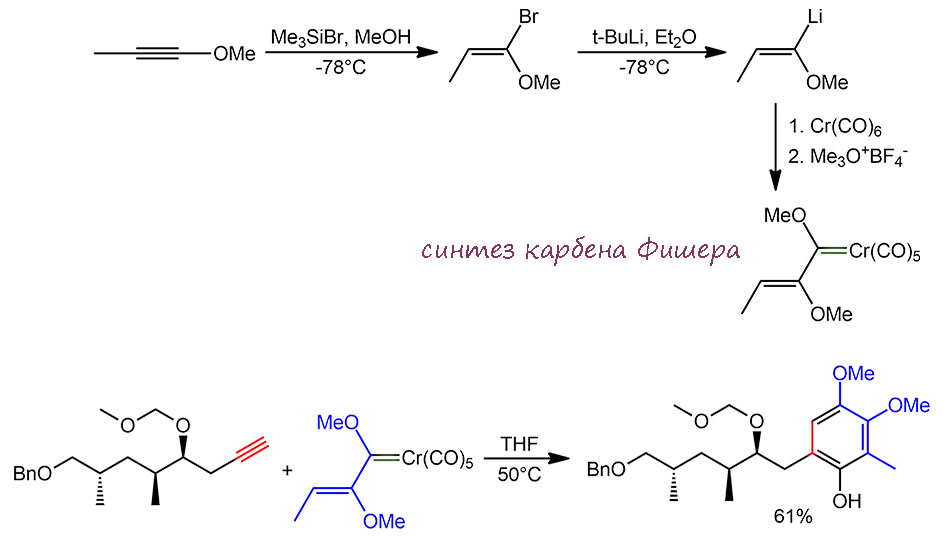
Ключевой стадией сборки ансамицинового антибиотика (-)-кендомицина стала реакция бензоаннелирования Дёца (J.D.White, H.Smits Org. Lett. 2005, 7, 235). Исходный карбен Фишера получили из метоксипропина присоединением HBr в мягких условиях (реакция идёт стереоселективно как син-присоединение) с последующим обменом Br-Li и реакцией с карбонилом хрома с гашением аниона триметиоксонием.
Реакция Дёца с терминальным олефином даёт искомый фенол, и как положено наиболее объёмистый заместитель в ацетилене (здесь единственный) встаёт ближе к фенольной группе.
Пример использования бензоаннелирования в синтезе витаминов К
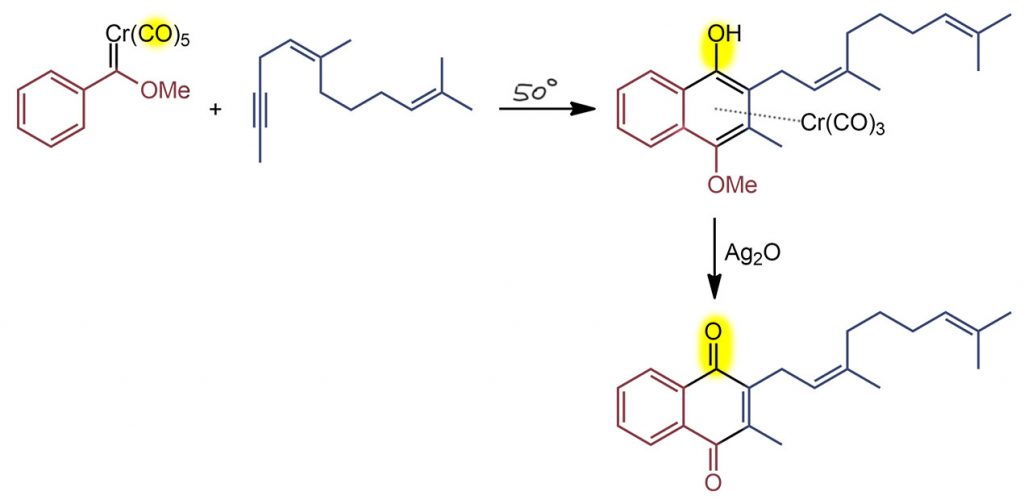
Сам Дёц сразу сообразил, что его новый метод как нельзя лучше приспособлен для синтеза витаминов группы К. Их много, это нафтохиноны приблизительно одного строения, и у большинства различается только боковая цепь. Очень простой карбен Фишера реагирует с ацетиленом, который нужно, конечно, сначала собрать, но это синтез для контрольной по первой теме на 3-м курсе. Дальше реакция Дёца, которая в этом случае даёт хромовый комплекс, и его нужно еще окислить для удаления хрома, но одновременно окисление даёт хинон, и это ровно то, что нужно. Всё семейство витаминов К делается одним этим методом, только хвосты надо заготовить в виде ацетиленов.
Внутримолекулярное аннелирование
Крэг Мёлик и сотрудники зацепились за механизм реакции Дёца и увидели возможность сделать внутримолекулярный вариант этой реакции без использования ацетилена. Для этого пришлось подумать, как заставить карбен Фишера преждевременно разродиться миграционным внедрением CO с образованием кетена. Просто так карбен Фишера не хочет этим заниматься, он стабилен и ленив. Но оказалось, что дело можно сильно ускорить фотохимически (Merlic C. A., Burns E. E., Xu, D., Chen, S. Y. J. Am. Chem. Soc. 1992, 114, 8722). Здесь не стоит бояться фотохимии – её назначение в реакциях комплексов переходных металлов часто вполне тривиальное – облегчить диссоциацию координационно-стабильных лигандов, что приводит к тому, что быстрее идут реакции, нуждающиеся в освобождении координационным мест. Никакой дополнительной активации, возбуждённых состояний и прочих пугающих нормального человека прелестей фотохимии здесь нет. Фотохимически активированная диссоциация происходит даже в присутствии избытка лиганда, и это тоже полезно, потому что лиганд может понадобиться, напрмер, в миграционном внедрении.
Вот пример такой реакции (C. A. Merlic, Y. You, D. M. McInnes, A. L. Zechman, M. M. Miller, Q. Deng, Tetrahedron 2001, 57, 5199–5212). Как видим, роль ацетилена играет уже готовый фрагмент с двойной связью, а остальные стадии очень похожи на то, что мы видим в обычной реакции Дёца, поэтому и не стоит делать из этого метода что-то отдельное. Протокол нашел неплохое применение в синтезе сложных молекул.
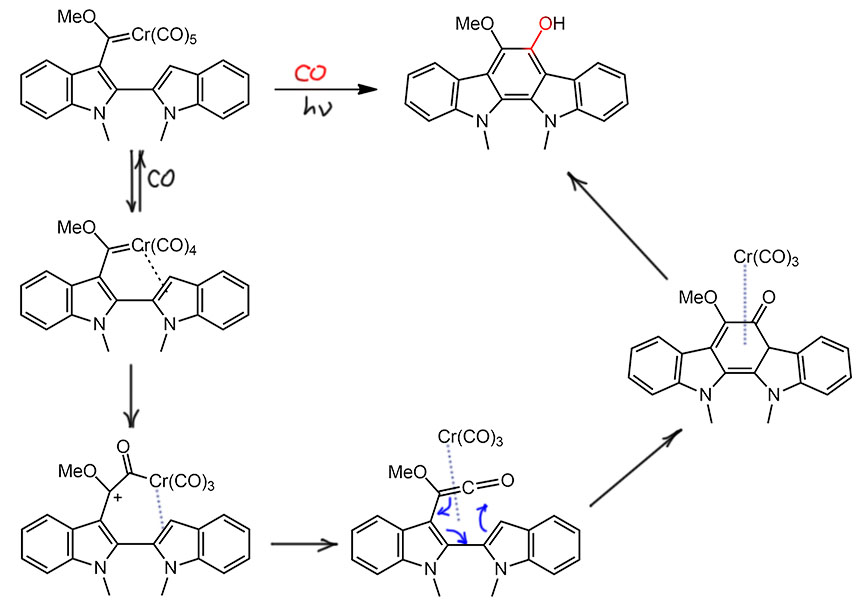
Головоломный каскад
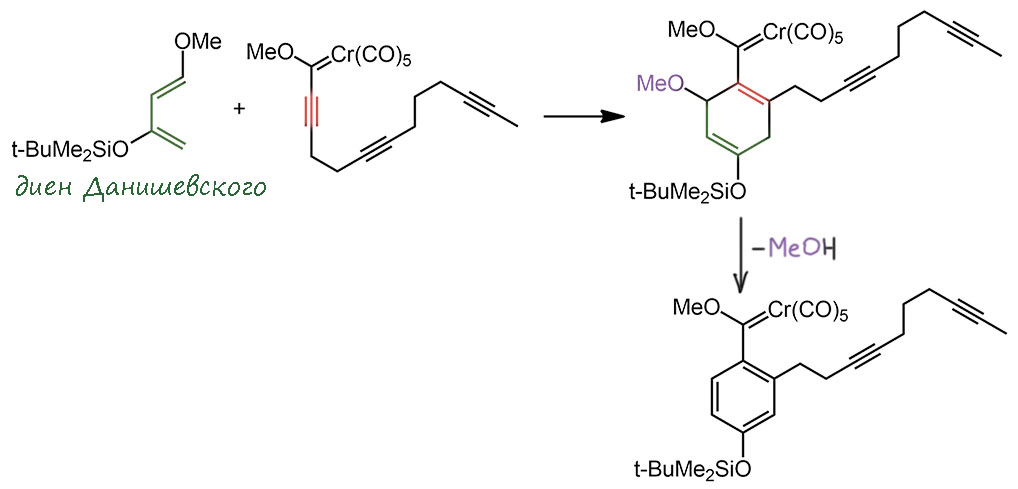
Реакцию Дёца можно использовать и ещё более сложных превращениях, и как оказалось, карбен Фишера способен участвовать в весьма нетривиальных каскадах. Одно из таких превращений описал колоритный американский химик Уильям Вульф с сотрудниками (J. Bao, W. D. Wulff, V. Dragisich, S. Wenglowsky, R. G. Ball, J. Am. Chem. Soc. 1994, 116, 7616–7630). Это даже не просто каскад, а процесс в одном ведре, начинающийся с другого применения карбенов Фишера – карбеновый узел работает как сильный акцептор, активирующий кратную связь к реакции Дильса-Альдера. Таким образом сначала сшили триен с очень популярным в синтезе диеном Данишевского. Из трёх тройных связей в реакции селективно участвует только активированная, и реакция еще и региоселективна. Из аддукта немедленно элиминирует метанол, чтобы получилось ароматическое кольцо.
Образовавшийся новый карбен Фишера – заготовка для запуска реакции Дёца в каскаде. Циклоприсоединение идет при комнатной температуре, а реакцию Дёца запустили нагреванием до 75°С. Смотрите, что происходит дальше – карбен пляшет по этой структуре не хуже, чем какой-нибудь палладий. Но только один раз, стехиометрически. Смотрим. Вот карбен вгрызается в первую тройную связь, образуется второй 6-членный цикл, а карбеновый узел выныривает в новом месте на расстоянии атаки на вторую тройную связь. Вгрызается теперь в неё – и вот уже образовался 5-членный цикл. Тройных связей больше нет, вгрызаться больше не во что (было бы, вгрызлись бы) поэтому пора внедрить СО, превратиться в кетен, и образовать гексатриеновую систему, готовую для перегруппировки, замыкающей последний цикл. На последней стадии возникает проблема – метокси-группа в узле мешает ароматизации и переходу из кетона в енол (фенол). Но она куда-то девается. Довольно загадочно. Авторы в статье это никак не комментируют – свалила и чёрт с ней. Вообще-то это нехорошо, если не знаете, так и напишите. Куда она могла деться? Элиминирование никакое не просматривается, я, по крайней мере, не вижу. Если увидите, напишите, буду признателен, осыплю плюсиками. У меня только гипотеза, что произошло восстановительное расщепление связи С-О, возможно с помощью нульвалентного хрома, который тоже куда-то делся. Поскольку на кону стояла ароматизация, это всегда сильно облегчает даже не самые выгодные реакции.
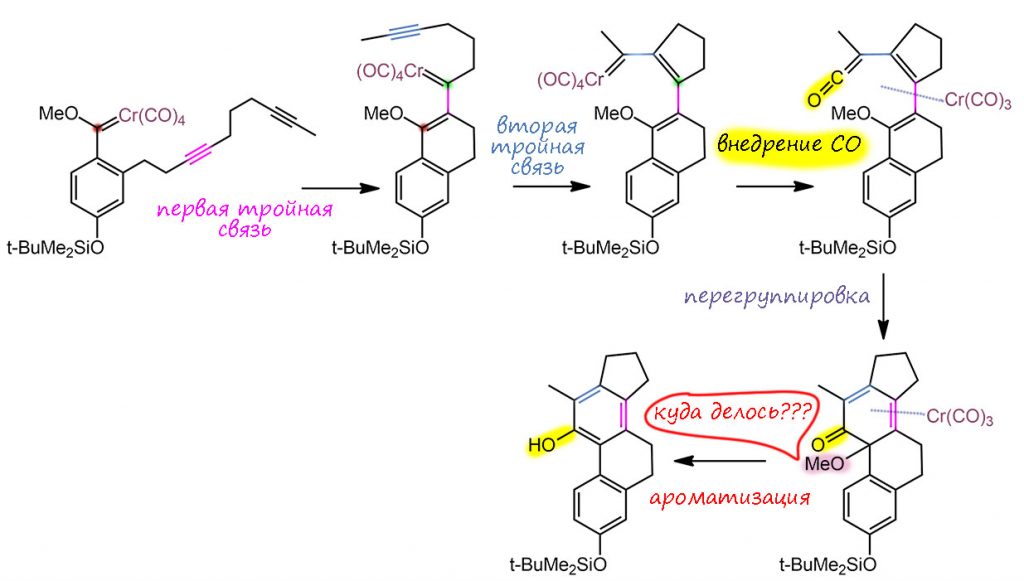
Это сасый настоящий каскад – карбонил хрома прыгает от одного реакционного центра к следующему, сшивая скелет будущей молекулы. Эффективность, конечно, не такая высокая как у палладиевых каскадов, но как прецедент – впечатляет.
Изонитрил в реакции Дёца
Уже много раз сказано, что изонитрилы это ближайшие аналоги оксида углерода. Вот, пожалуйста, в работе Крэга Мёлика и сотрудников просто добавили немного разных изонитрилов к внутримолекулярной реакции Дёца (Merlic C. A., Burns E. E., Xu D., Chen S. Y. J. Am. Chem. Soc. 1992, 114, 8722). Получилось, например, вот что:
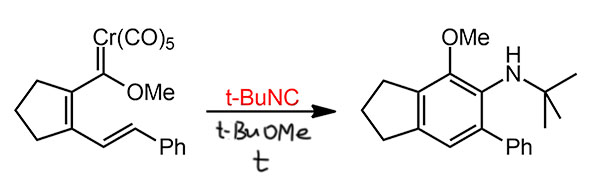
Метил-трет-бутиловый эфир (МТБЭ), использованный в этой реакции – просто эфирный растворитель с немного более высокой температурой кипения, чем у обычного эфира.
Попробуйте разобрать механизм реакции и проследить, когда в нем появляется изонитрил и что происходит дальше. Попробуйте также объяснить, почему изонитрил шутя выигрывает конкуренцию у оксида углерода, который в виде карбонильных лигандов никуда не девается.
До 30 плюсиков за содержательный ответ. Если полезете в оригинальную статью, учтите, что она не очень хорошо написана и разбираться в ней удовольствие невеликое. Поэтому лучше самостоятельно подумать.
