Макроциклизация в реакции Бачуолда-Хартвига
Макроциклизация – понятие довольно широкое и не до конца точно определенное. Есть более-менее определенное понятие о том, когда цикл становится макроциклом. Дело не в размере, размер это только предпосылка, а в том, что у макроцикла в середине кольца должна быть дырка, в которую можно что-нибудь запихнуть. Это может быть ион металла, а может быть и другая молекула, иногда немаленькая, впрочем мы не обязаны запихивать ее туда целиком, а можем только кусочек. Во всех случаях мы имеем дело с образованием новых соединений, и это могут быть и обычные координационные комплексы, и супрамолекулярные сборки типа гость-хозяин. Это очень интересная химия, поэтому макроциклы уметь получать нужно, это общественно-полезная деятельность, поощряемая похвалой, грантами, а иногда даже и нобелевскими премиями (минимум две – давнишняя Лену, и недавняя Соважу, Феринге и забыл третьего – зависят от макроциклов и их весьма необычных свойств).
Потребность есть, а получать макроциклы непросто, потому что против них работает такая зловредная наука как теория вероятностей во всех своих проявлениях начиная от не менее зловредной комбинаторики – чтобы большой цикл замкнулся, должны встретиться концы длинной цепи и прореагировать – поэтому вероятность такого собятия это произведение вероятности встречи и вероятности реакции. Вероятность встречи непостредственно зависит от того, сколько более-менее выгодных конформеров длинной цепи имеют сближенные концы – очень мало, и чем длиннее и гибче цепь, тем меньше, комбинаторика здесь ужасная, и с каждым дополнительным атомом в цепи общее количество конформеров всё быстрее улетает в тот самый космос, из которого сегодня, 15 июля 2022 года, пробкой вылетел один мордатый, наглый и бездарный персонаж. А количество годных конформеров со сближенными концами остается постоянно маленьким – несколько штук из тысяч, миллионов, миллиардов, триллионов, и т.д. Печалька. Поэтому чтобы совсем не впадать в отчаяние макроциклисты хоть немного, но компенсируют этот ужасный счёт тем, что для макроциклизации используют особо быстрые реакции (когда реакция быстра, это приблизительно соответствует утверждению, что вероятность реакции при встрече реагентов высока или даже равна единице – больше не бывает), чтобы хотя бы эти редкие встречи не заканчивались конфузом – хотели, но не смогли, ждите следующей встречи для второй попытки. Эта идея в этой химии подстпудно существует с давних времен столетней давности, когда великий хорватско-швейцарский химик Леопольд Ружичка впервые показал, что циклы могут быть большими и очень большими и нашел реакции, которые можно для этого применить. С тех пор в химии и утвердилась идея, что для макроциклизации годится не любая реакция, и сформировался особый список реакций макроциклизации.
Но здесь есть два очень важных момента. Первый состояит в том, что другие реакции тоже могут быть использованы, потому что все в химии относительно, и если вы можете смириться с очень малым выходом, и если знаете как достать из реакционной смеси целевой макроцикл, и если вам просто нужно любой ценой получить соединение, то можете использовать любую реакцию, у которой есть внутримолекулярный вариант – и далее будете доставать продукт. Таким способом были, например, получины совершенно гигантские циклы, о чем можно почитать на моем органическом сайте на страничке ответов на вопросы.
Второй момент состоит в том, что не всегда нужны циклы, сделанные из очень гибких цепей. Самое страшное – полностью насыщенные цепи, у них неверотяно много конформеров. Любые вставки жестких элементов, хоть кратных связей, уменьшают количество конформеров. А если цепь в основном состоит из жестких элементов, вставок циклов, каркасных структур, или даже полужестких элементов, таких как карбонильные группы, сопряженные с кратными свзями и т.д., то конформеров становится намного меньше, и вероятность циклизации возрастает, и для циклизации становится возможным применить и методы, не входящие в стандартный арсенал круг макроциклизаций, и достигать успехов. Это важно, потому что чем большим количеством реакций вы можете воспользоваться для достижения цели, тем больше шанс, что вы ее реально достигнете.
Немного жёсткости и никакого мошенничества!
Такой химией уже давно и очень успешно занимается д-р Алексей Аверин и его коллеги в лаборатории И.П.Белецкой. Соединить всевозможные амины с макроциклами – богатая идея, и то и другое сулит много интересного, и соединение этих структурных типов дает множество новых молекул с впечатляющим диапазоном всяких полезных свойств. Но есть одно условие, которое впрочем не является обременительным, – циклизовать лучше как раз такие цепи, в которых есть некоторое количество элементов, ограничивающих подвижность. Но это ровно то, что нужно для того, чтобы получаемые молекулы имели интересные свойства. В общем, получается очередное подтверждение справедливости притчи про братца Кролика, который умолял братца Лиса не бросать его в терновый куст. Не надо применять реакцию Бачуолда-Хартвига, чтобы получить гибкий макроцикл с одной-двумя кратными связями или вообще без них! – А никто и не собирался!!
Вот характерный пример такого синтеза. в качестве остова используется стероидная система из класса желчных кислот. Это совершенно жёсткий каркас, не имеющий никаких конформационных движений, с небольшим боковым хвостом длиной в 5 атомов и приделанными на концах м-бромфенильными остатками. Эти концевые группы имеют органиченную конформационную подвижность и количество доступных конформеров невелико. Всё это связывают вполне впечатляющими отрезками олигоэтилен- или олигопропилендиаминов, или диаминов на основе олигоэтиленгликолей, длиной до 15 атомов. Это много и это гибко – соответствющая углеродная цепь извивалась бы как ненормальная, порождая гигантское количество конформеров приблизитеьно одинаковой энергии (на моем органическом сайте конформационные приключения длинных гибких цепей и бесконечные тёрки между энтропией и энтальпией обсуждаются, например, на страничке про нежесткие молекулы), но – здесь не углеродная цепь, а цепь через каждые два-три атома углерода имеющая кислородную или азотную вставку. И эти вставки сильно изменяют конформационные равновесия и сами по себе, и особенно, когда в растворах встречаются с ионами металлов, даже таких невинных как щелочные. Ионы металлов электростатикой подтягивают к себе атомы электроотрицательных неметаллов, складывая цепочку скорее в такие скобки, у которых концы уже не болтаются свободно, а пребывают в некотором достаточно ограниченном конформационном пространстве. В этом месте надо хорошо понять, что это понятно из общих соображений, но ни один исследователь никогда не скажет, насколько эти конформеры соответствуют задаче образования цикла – на это дает ответ эксперимент. Или даёт, или не даёт, но так или иначе, исследователи, занимающиеся методами образования больших циклов отлично знают, что любое органичение конформационной подвижности (жёсткие или полужёсткие вставки в цепи, жесткие фрагменты, гетероатомы с возможностью координации ионов металлов и т.п.) могут здорово помочь. Кстати, они же могут и помешать, если все эти штуки в каком-то случае лягут так, что категорически помешают концам встретиться даже случайно – в таких случаях большой цикл не получается хоть тресни. Но это очередное воплощение старой теоремы о встрече с динозавром на улице Горького – после того, как встреча случилась, можно рассуждать о том, почему так много динозавров вдруг вывалило на главную улицу столицы и не собирались ли они втречать Первомай, но немного ошиблись временем. А если не случилась, мы с умным видом заявим, что это потому что динозавры вымерли в меловом периоде, помните такой? – Как же, как же, как вчера.
Итак, если задача состоит в том, чтобы соединить такие фрагменты в большой или даже очень большой цикл, к вам может прийти большая удача. Косвенным, но очень ярким признаком того, что цикл образовался не только потому, что вы великий химик и очень точно подобрали каталитическую систему (это и так ясно и в доказательствах не нуждается), но и потому что в гибкой цепи нашлись довольно жесткие кусочки, сильно сократившие количество конформеров в равновесии, а дополнительно вам помог эффект ионов металла, который часто по недоразумению называют темплатным, и этот эффект дополнительно сократил множество конформеров – является то, что хорошие выходы продуктов получаются при не очень высоких степенях разбавления реакционных смесей. В настоящей макроциклизации, когда цепь по-настоящему гибка, и ничего не помогает – редко используют концентрации выше микромолярных, а выходы редко превышают 10-20% (часто и 1-2%-ному выходу макроцикла суровые исследователи радуются, как малые дети в макдональдсе – где-где? – ну, забудем об этом). Если же у вас концентрации хоть и небольшие, но скорее миллимолярные, а выходы достигают 40, а то и 60% – знайте, что вам помогли специально уполномоченные боги, отвечающие за мощности множеств конформеров. Вот как в этом примере, одном из многих описанных в статье Аверина и сотрудников (A.D.Averin, E.R.Ranyuk, N.V.Lukashev, I.P.Beletskaya Chem. Eur. J. 2005, 11, 7030 – 7039). Как видим, выход неплох, а там есть примеры и с выходами за 60% причём для циклов большего размера. Кстати, при макроциклизции действительно гибких цепей такого не бывает, и чем больше цепь, тем ниже выход, тем большие разведения используют. А когда выход даже растет это признак того, что работают факторы, снижающие гибкость, например, то же взаимодействие с катионами металлов, и тогда может оказаться, что эффективные размеры взаимодействующих частей немного случайно могут лучше подходить друг к другу, но это можно узнать только с помощью хорошего моделирования структуры.
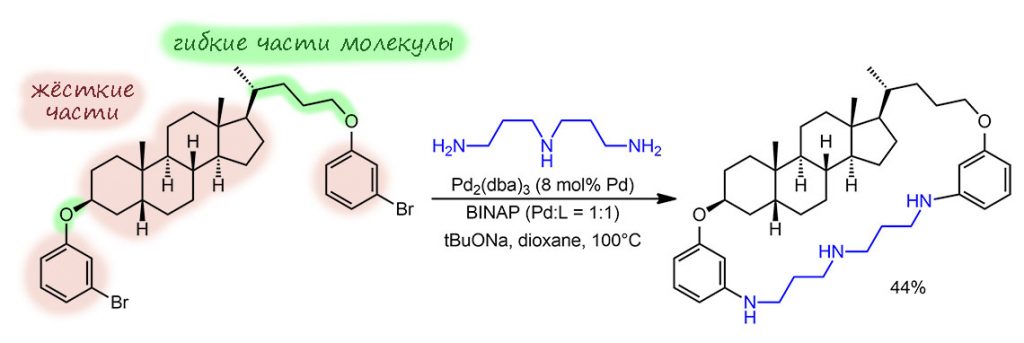
Еще раз повторим важные вещи. Это макроцикл? Да, безусловно. Это макроциклизация? И в том сомненья нет. Мы просто видим, что, как всегда в химии, человек предполагает, а структура определяет результаты реакций; конкретные особенности структуры оказываются важнее общих соображений. И мы только предполагаем эти особенности, хотя в совсем современных статьях последнего десятилетия квантово-химическое моделирование хода реакции становится почти обязательной частью исследования. Это не дает полной уверенности, но позволяет избежать ошибок, когда на бумаге кажется, что все подходит, и вот та штука в эту встанет как всегда здесь была, а в реальности просто расстояния не те, или реальные конформеры оказались далеки от тех, которые могут участвовать в циклизации.
В группе д-ра Аверина исследовали огромное количество макроциклизаций таких неполностью гибких молекул, состоящих из цепочек полиаминов или полиэфиров и тех или иных фрагментов, придающих молекулам всякие интересные свойства и функции. Посмотрим еще на одну интересную молекулу, которая была у нас в самом первом квесте в 2018 году.
Чудо с ручкой: энантиоселективный Бачуолд-Хартвиг
Как мы уже привыкли, современную химию бигмаком не корми (а что это? забудем, уже неважно), дай сделать что-нибудь асимметрическое. Даже олефины уже бромируют энантиоселективно. А вот реакцию Бачуолда-Хартвига сделать энантиоселективно непросто. Где там может взяться стереогенный центр и энатиодискриминация (мы против всех видов дискриминации кроме энантиодискриминации!)? Субстраты все ароматические, плоские как современные анекдоты – в плоскости не найдём мы стереогенных центров. Нуклеофилы – амины. Аминов полно хиральных, но только не за счет заместителей на азоте – разнозамещённые амины конфигурационно неустойчивы, если заместители не фиксированы дополнительно мостиками. Ну вот, вроде и всё – негда искать энатиоселективность в самой реакции C-N кросс-сочетания, ведь мы никогда не используем алифатические электрофилы в этой реакции (в отличие от С-С кросс-сочетания, гда это хоть и проблема, но не неразрешимая). Но нет таких препятствий, который не смогли бы преодолеть наши ученые, и хитроумный д-р Аверин и его коллеги, неутомимые в поиске новых макроциклических архитектур, нашли способ сделать эту реакцию энантиоселективной (Ranyuk E.R., A. D. Averin, I. P. Beletskaya Adv. Syn. Cat. 2010 352, 2299 – это задание под кодом I было в квесте 2018 года). Ключ – в слове плоскость. В плоскости не может быть стереогенных центров, но вот саму плоскость можно сделать стереогенной, как мы уже убедились на примере открытия семейства фосфинов Жозифосов, обязанных своими свойствами именно стереогенной плоскости, хотя в этих молекулах есть еще и обычный стереогенный центр. Отсюда мы немедленно понимаем, что введение амино-группы с заместителями в уже замещенный ферроцен или какую-то похожую штуку, а таких немало, дало бы нам возможность искать энатиоселективности, иными словами, можно было бы попробовать построить что-то, похожее на типичный Жозифос, но только не фосфин, а амин, и с помощью реакции Бачуолда-Хартвига, но вот зачем и кому это нужно. Но идея Аверина и сотр. намного изящнее и оригинальнее – создать макроциклическую хиральную молекулу с хиральностью, обусловленной именно стереоплоскостью.
И взяли они в качестве субстрата совершенно плоскую ароматическую молекулу – 1,5-дихлорантрахинон, как мы уже понимаем, не только плоскую, но и совершенно жёсткую. И навесить на нее свои любимые полиаминные цепи. В этом месте сразу хочется воскликнуть – но там расстояние огромное, молекулу придется огибать, потребуется длинный полиамин, а он уже скорее всего не захочет дарить нам подхоящих конформеров, потому что так изогнуть длинную молекулу совсе маловероятно. Так, а что если не обходить стороной , а попробовать изогнуть цепь такой ручкой над плоскостью. Такой структурный принцип довольно хорошо известен, такие молекулы, где боковая цепь в ароматической системе, присоединенная к двум положениям, зависает над кольцом, – это разновидности семейства циклофанов, их любят исследовательи для самых разных задач. И мы видим, что эта ручка уничтожает плоскость симметрии самой ароматической молекулы, но если ее еще и присоединить наискосок, то заодно уничтожаются и все остальные плоскости симметрии (именно поэтому галогены были в положениях 1,5, а не 1,8). Вот так: мы видим, что если бы цепочка все же смогла обогнуть молекулу, плоскость симметрии осталась бы на месте и никакой хиральности не возникло бы (если сама цепь не содержит стереогенных элементов, конечно). Кто-то скажет – но длинная гибкая цепь не ляжет же в плоскость, она будет извиваться над и под. Да, конечно, но в среднем можно сказать, что она в плоскости – это знакомый нам принцип конформационного анализа: имеет значение не какие там мгновенные конформации, а среднее; любая гибкая молекула в любой момент времени изогнется так, что будет фактически хиральной, но в большом множестве молекул в веществе обязательно найдется зеркально симметричная, точне даже сказать, не обязательно найдётся, – кто её там будет искать – а обе формы равновероятны. А вот если ручка окажется короче и пройдет над или под плоскостью молекулы, все – все плоскости накрылись, и никакое усреднение этого не изменит, потому что зеркально симметричная молекула – это так, у которой ручка с другой стороны, но изгибанием короткой ручки этого достичь без разрыва ручки невозможно.
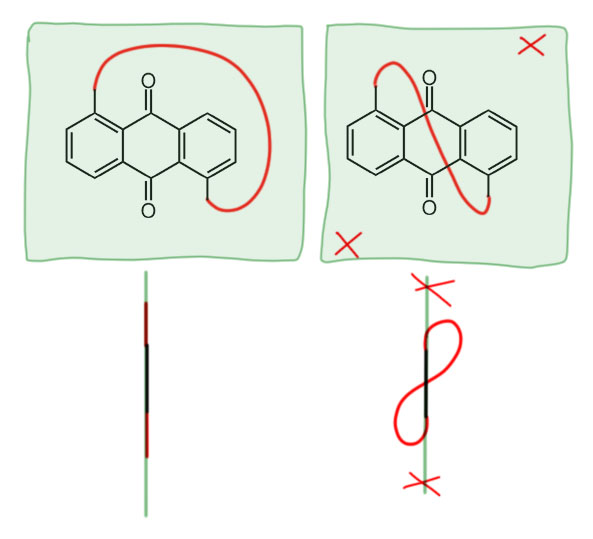
Природа ручки при этом неважна, если она не содержит стереогенных элементов и удовлетворяет условию – она короче такой, которая может обогнуть молекулу сбоку. Итак, есть два способа продеть эту ручку – с одной стороны и с противоположной стороны. Эти молекулы энантиомерны, в чем легко можно убедиться даже визуально – поставьте мысленно зеркало между ними и убедитесь, что одно отражается в другое.
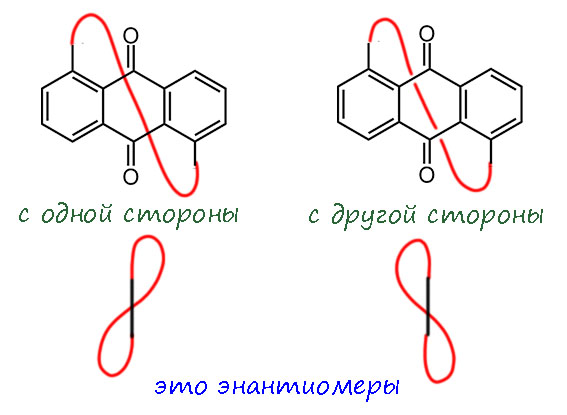
И никаких других способов продеть ручку и получить ещё что-то нет. Обратите внимание на этот факт – это фундаментальное следствие из того, что в них есть только один стереогенный элемент, неважно какой, но один. Здесь это стереогенная плоскость при отсутствии других элементов, она одна, а следовательно, стереоизомеры являются энантиомерами, а энантиомеров два и только два. Если бы стереогенных элементов было два или более, мы бы имели дело и с энантиомерами и с диастереомерами, молекул было бы не две, а больше. Это такое редчайшее место в химии, когда выводы получаются с неотвратимостью, свойственной настоящей математике.
Теперь смотрим, как это получилось в реальности. Дихлоантрахинон реагировал с достаточно длинным диамином, собранным на диэтиленгликоле. Цикл замкнулся. В отсутсвие источников хиральности (и антрахинон и амин нехиральны, и катализатор нехирален, если в нем оптически неактивный лиганд, например, рацемический BINAP) получилась смесь продуктов ручка-сверху и ручка-снизу, то есть рацемат. Но когда использовали хиральные фосфины, произошла асимметрическая индукция, она же перенос хиральности – и получился оптически активный продукт. Впрочем, оптически чистый (R)-BINAP несильно помог – энантиомерный избыток в 3% ещё надо было умудриться заметить. Оптимизация лигандов вывела на уже хорошо знакомые нам Жозифосы, из которых самым лучшим оказался CyPF-tBu, выдавший аж 58% энантиомерного избытка. Мы привыкли к гораздо большим цифрам? Но не в таком необычном случае, где ручка равновероятно заворачивается с той или другой стороны плоскости, но когда происходит второе кросс-сочетание и ручка замыкается, расположение хирального лиганда относительно плоскости антрахинона создает разницу в энергиях переходных состояний. Довольно интересно, что лучше всех сработал именно Жозифос, лиганд с плоскостной хиральностью. Но это никакой не закон и даже не закономерность, напротив, стереохимия учит, что все хиральности равны и все хиральности нужны, и мы выбираем на вкус, под вкусом подразумевая реальные результаты опытов по подбору наилучшей системы. Можно быть уверенными, что если бы набор лигандов был шире, нашелся бы и лиганд получще, и он мог бы вполне быть C2-симметричным, то есть иметь хиральную ось, или даже просто хорошо спроектированной хиральной молекулой с одним стереоцентром.
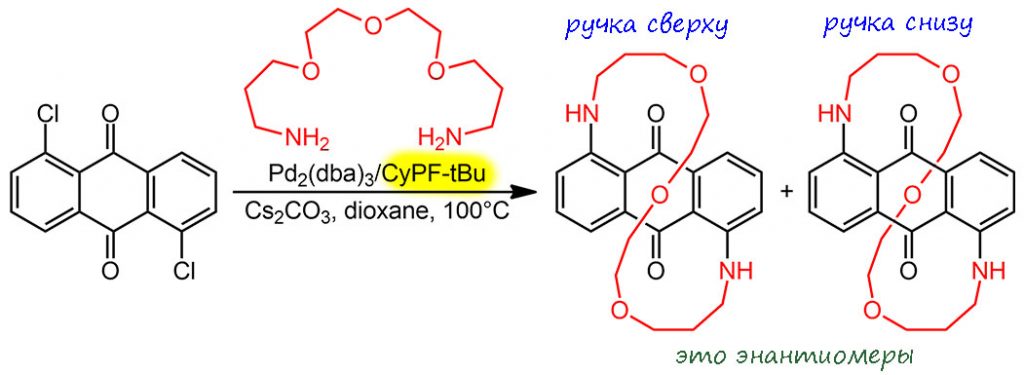
Я специально не пишу, какой из энантиомеров получился в избытке, потому что мы уже хорошо знаем один из принципов асимметрического синтеза – если субстраты нехиральны, а перенос хиральности происходит извне – из реагента или катализатора, и возникает только один стереогенный элемент – то можно получить оба энантиомера, просто взяв разные энантиомеры реагента или катализатора. А Жозифосы доступны в виде обоих энантиомеров – какой выберем, такой и продукт получим. При этом конкретной простой связи между энантиомером лиганда и энантиомером продукта нет – это число экспериментальный результат, который можно попробовать понять, только если у нас получится моделировать переходное состояние, а это до сих пор не очень легко сделать.
Обращу еще внимание на то, что мы рисуем ручку восьмёркой, и может возникнуть ощущение, что это почему-то очень важно. Это не так – совсем не важно во-первых, и во-вторых, ручка в реальности никакая не восьмёрка. Это просто петля, которая аккуратно огибает антрахиноновый остов. И теоретически можно было бы ее взять совсем короткой – просто таким мостиком над антрахиноном – ходите по нему и рассматривайте все эти кольца и атомы. И это точно так же было бы энантиомерами. Но – в очередной раз напоминаю, что молекулы в реальности это не тоненькие чёрточки связей, а большой толстый шмат электронной плотности, далеко выходящий за контуры структурной формулы. Ручка не может подойти близко к этой электронной туше, потому что и сама не тоненькая как ниточка – это такая хорошая колбасина, и задача приспособить макроциклическую ручку к ароматической молекуле больше похожа на приделывание длинной колбасы к индюшачей тушке – можете заняться на досуге, придумав какое-нибудь кулинарное обоснование этому занятию. Сближение молекул приблизительно соответствует размерам, задаваемым ван-дер-ваальсовыми радиусами атомов, и сближение хоть немного более близкое вызывает огромное увеличение отталкивания и электростатического, и по принципу Паули. Поэтому химия вот таких молекул – циклофанов – всегда упирается в то, что при уменьшении длины таких ручек в определенный момент собрать молекулу становится невозможно – отталкивание разрывает ее на части. Длина ручки в этой работе только кажется большой, на самом деле она очень близка к предельной, сократить сильно ее не удалось бы, поэтому мы можем только нарисовать молекулу с короткой ручкой между атомами, но получить реально такую просто не получилось бы.
